|
10月9日,国家药品监督管理局药品审评中心发布了关于公开征求《化学仿制药参比制剂目录(第五十批)》(征求意见稿)意见的通知。

通知内容显示:根据国家局2019年3月28日发布的《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号),国家局中心组织遴选了第五十批参比制剂,现予以公示征求意见。
公示期间,请通过参比制剂遴选申请平台下“参比制剂存疑品种申请”模块向药审中心进行反馈,为更好服务申请人,反馈意见请提供充分依据和论证材料,反馈材料应加盖单位公章,并提供真实姓名和联系方式。公示期限:2021年10月9日~2021年10月21日(10个工作日)。
据通知文件梳理发现,本次共有涉及27个新增参比制剂,41个目录增补,21个审议不通过。
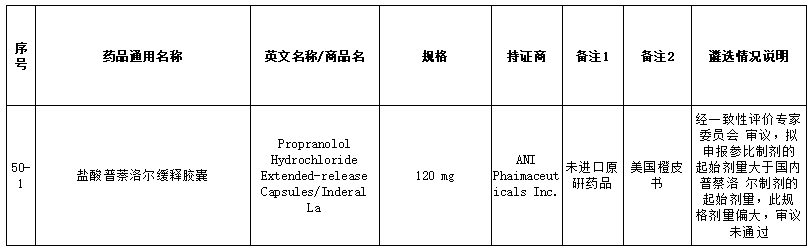
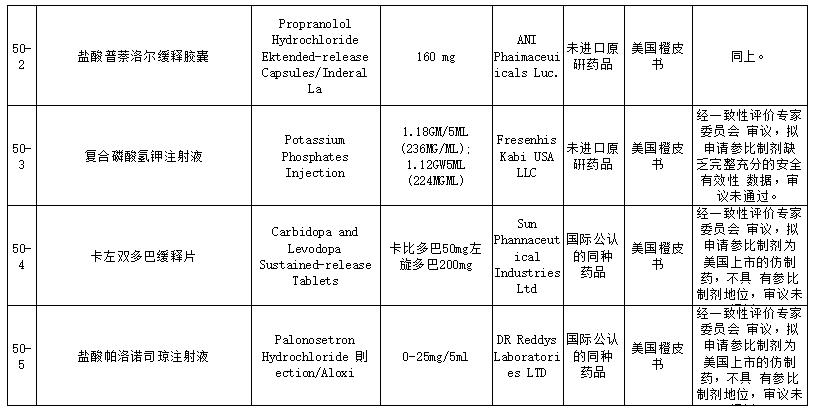
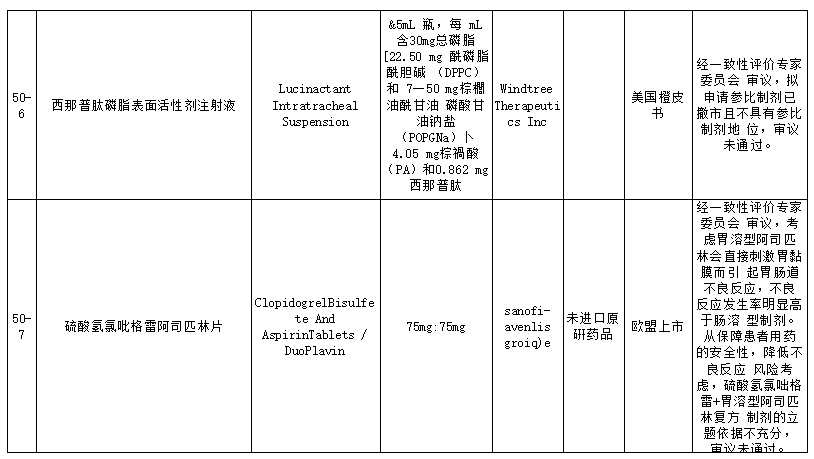
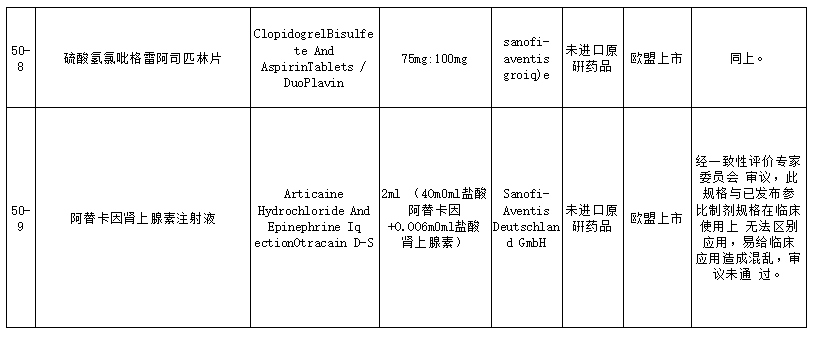
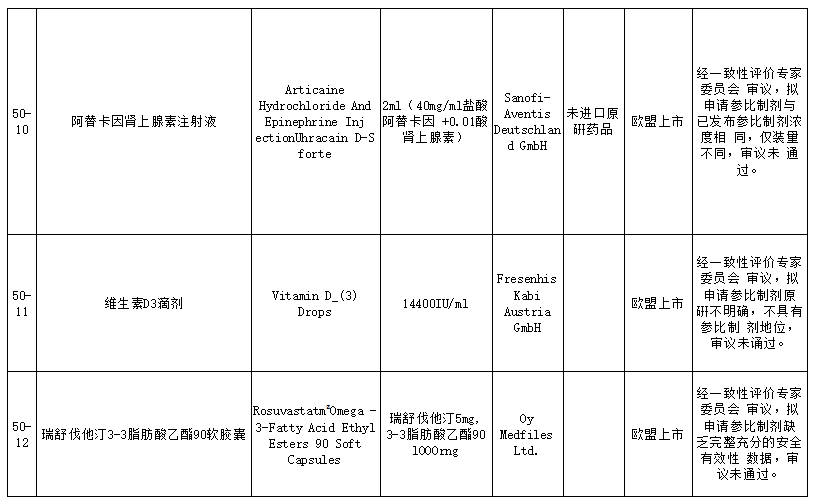
在25个未通过仿制药参比制剂中,包括盐酸普萘洛尔缓释胶囊、复合磷酸氢钾注射液、卡左双多巴缓释片、盐酸帕洛诺司琼注射液、西那普肽磷脂表面活性剂注射液、硫酸氢氯吡格雷阿司匹林片、阿替卡因肾上腺素注射液、注射用丝裂霉素、瑞舒伐他汀ω-3脂肪酸乙酯90软胶囊等品种。就未通过审议的品种原因来看,主要包括以下方面:
经一致性评价专家委员会审议,本品原研不明确,拟申请参比制剂为欧盟上市的仿制药,不具有参比制剂地位,审议未通过;此前未通过审议公示,收到企业提出异议后,经专家审议维持原结论,二次审议未通过;经一致性评价专家委员会审议,为确保参比制剂的质量,建议参比制剂首选欧盟、美国以及日本等监管体系较为完善的机构批准上市的原研药品,审议未通过等原因。
其中硫酸氢氯吡格雷阿司匹林片未通过审议主要是因经一致性评价专家委员会审议,考虑胃溶型阿司匹林会直接刺激胃黏膜而引起胃肠道不良反应,不良反应发生率明显高于肠溶型制剂。从保障患者用药的安全性,降低不良反应风险考虑,硫酸氢氯吡格雷+胃溶型阿司匹林复方制剂的立题依据不充分,审议未通过。
附:未通过审议的仿制药名单

|