|
12月22日,国家药监局发布了一则关于国家医疗器械监督抽检结果的通告,共计37家生产企业被查出产品不合格。
通告内容显示:为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对18个品种进行了产品质量监督抽检。
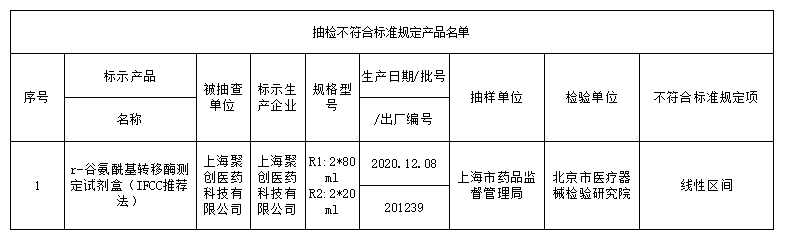
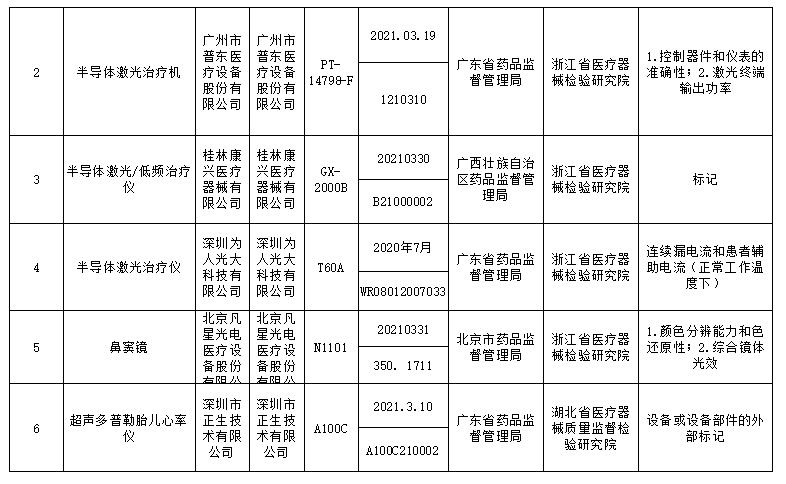
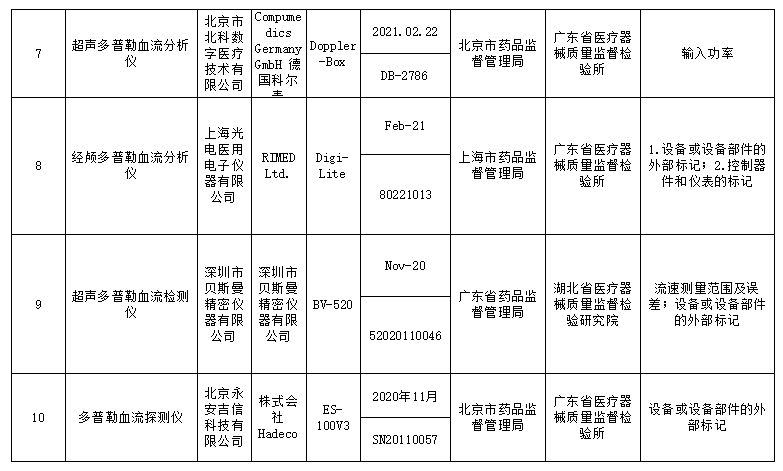
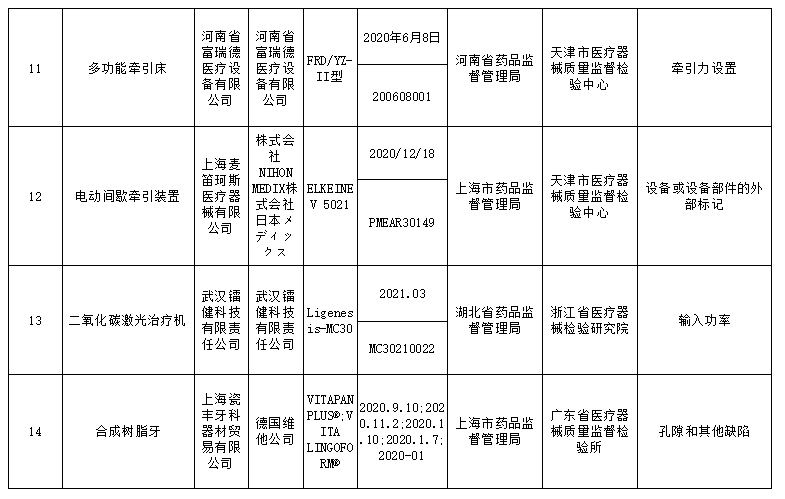
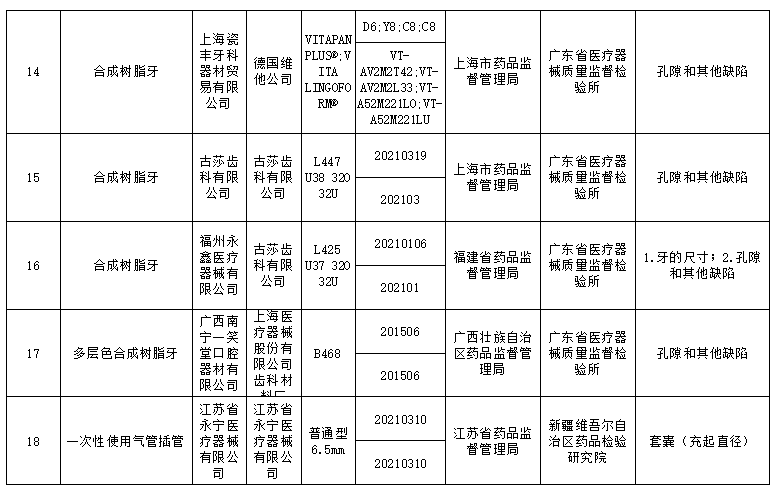
此次国家药监局抽检中发现共有18个品种39批(台)产品不符合标准规定,不合格产品涉及:r-谷氨酰基转移酶测定试剂盒(IFCC推荐法)、半导体激光治疗机、鼻窦镜、合成树脂牙、一次性使用气管插管、超声多普勒胎儿心率仪、软性亲水接触镜、一次性使用手术衣、医用超声雾化器等;不合格项目包括线性区间、标记、功率、噪声、孔隙等缺陷。
标示的生产企业有深圳市摩力康医疗科技有限公司、上海聚创医药科技有限公司、江苏鱼跃医疗设备股份有限公司、广州市普东医疗设备股份有限公司、南昌市朝阳医疗保健用品有限公司、上海医疗器械股份有限公司齿科材料厂、德国维他公司、桂林康兴医疗器械有限公司、深圳为人光大科技有限公司、Compumedics Germany GmbH 德国科尔麦、RIMED Ltd.、武汉镭健科技有限责任公司、古莎齿科有限公司、甘肃康视达科技集团有限公司、杭州博拓生物科技股份有限公司、波士顿科学公司Boston Scientific Corporation、Cook Incorporated 库克公司等。
查询各省药监局公告发现,河南省富瑞德医疗设备有限公司此前就多次被查产品不合格的情形,就在12月16日,甘肃省药监局就查出该企业生产的医用防护口罩不合格;此外,8月6日,河南省发布通告称,在对该公司生产的多功能牵引床进行核查时,发现“牵引力设置”项不符合规定,因此对其处以了2万元的行政处罚。
除此之外,江苏鱼跃医疗设备股份有限公司此次被查生产的电动洗胃机存在流量不符合规定的项目,值得注意的是,就在12月6日,江苏省药监局就对其生产不符合规定的电动洗胃机处以了14.7万元的处罚;而这也不是今年以来该公司第一次涉及行政处罚事件,在5月份还因生产的睡眠呼吸机未经审查发布广告被上海市市场监督管理局罚款10万元。
对于抽检中发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。省级药品监督管理部门要督促企业对抽检不符合标准规定的产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。具体详情如下:

|