|
广东即将出台医疗机构用药供应目录管理指南2022版。这相当于医院准入的全套资料,药企需多关注。
其中指出:药品配备按基药“1+X”模式,基层、二级、三级医院基药数量比例为986;药品规原则不超1500种,一品两规;对抗菌药物品种、品规数量也有明确的要求。
引进药品为临床必需、使用安全、疗效确切,基本用药供应目录内没有同类药品或与基本用药供应目录内药品相比有一定优势的品种。对于临床优势明显、安全性高或临床急需、无可替代的国家医保谈判协议期内药品和新型抗肿瘤药等创新药物,应简化引进流程,及时纳入。另外,七种情况将被调出。
近日,业内流传一份关于征求《广东省医疗机构基本用药供应目录管理指南(2022年版,征求意见稿)》意见的函,根据文件,为进一步加强广东省医疗机构基本用药供应目录的规范管理,促进医疗机构科学合理配备药品,在广东省卫健委2012年印发的《广东省医疗机构基本用药供应目录管理指南》的基础上,修订形成2022年版。
意见稿指出,二级以上医疗机构应成立药事管理与药物治疗学委员会,其他医疗机构应当成立药事管理与药物治疗学组。紧密型县域医共体(医疗集团)应建立药品联动管理机制,由牵头单位组建统一的药事管理与药物治疗学委员会,已聘任总药师的,由总药师负责紧密型县域医共体(医疗集团)药事管理与药物治疗学委员会的组织、协调与日常管理工作。
此前(2020年2月26日),国家卫健委等6部门联合发布《关于加强医疗机构药事管理促进合理用药的意见》,其中提出:“强化医疗机构药事管理与药物治疗学委员会作用,成立国家级、省级、地市级药事管理与药物治疗学委员会。”
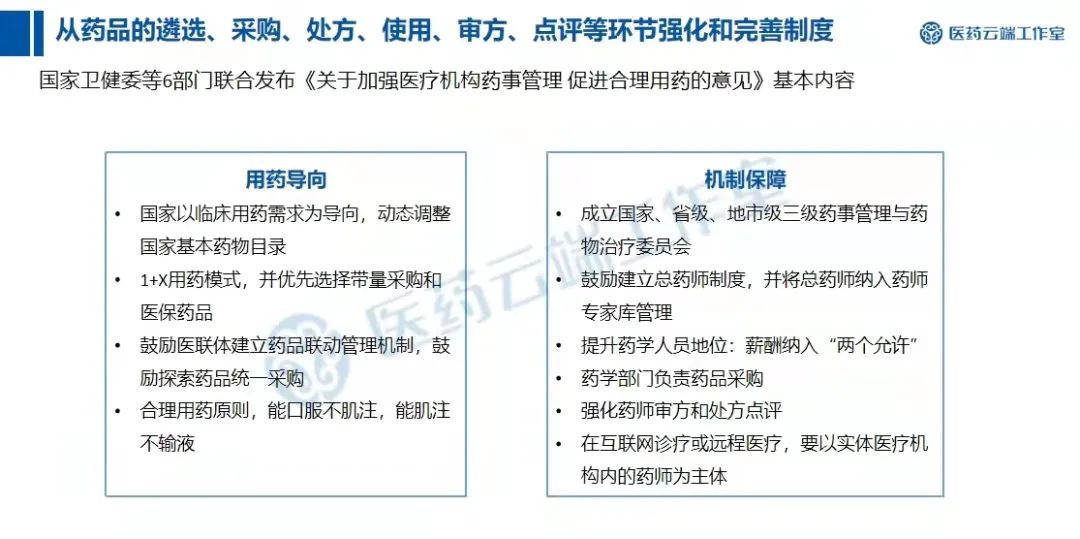
目前,除各医疗机构药事会外,还有国家、省级、地市级,一共是四级药事会,随着这四级药事会的相关架构与职能的不断优化、完善,药事服务管理工作也将更加统一和强化。
而对于药企来说,这意味着,往后不论是各类目录的准入,还是医院准入和用药,这些新增的各层级药事会,将使药品的市场准入工作更具挑战性,也更加复杂和不确定,药企准入部门的工作也需要重新梳理了。
下面,我们一起来看看广东省这份指南的重点内容。
意见稿指出,医疗机构基本用药供应目录主要是指本机构临床配备使用的全部西药和中成药目录,可细分为抗菌约物、抗肝溜约物、国家谈判药品、罕见病用药供应目录等子目录。目录内容含药品通用名、剂型、规格、药品生产企业或药品上市许可持有人、供应本机构的药品经营企业等基本信息。
中药饮片供应目录管理规定由各医疗机构自行制定。各医疗机构应建立完善基本用药供应目录管理制度,依据安全、有效、经济的用药原则和本机构疾病治疗特点,对目录内药品进行周期性调整,不断优化用药结构。
医疗机构基本用药供应目录管理原则
(一)药品配备原则:基药“1+X”,986
各医疗机构要按照以国家基药为主导的“1+X”(“1”为国家基药目录,“X”为非基本药物)用药模式,优先配备使用国家基本药物,逐步实现政府办基层医疗卫生机构、二级公立医疗机构、三级公立医疗机构基药配备品种数量占比原则上分别不低于90%、80%、60%。
非基药优先选择国家医保谈判协议期内药品、国家集采、省集采协议期内药品、国家医保目录药品以及国家卫生健康委公布的临床诊疗规范、诊疗指南、临床路径涉及的药品。医疗机构应优先保障儿童、孕产妇、老年、罕见病患者等特殊人群用药需求。
(二)药品品规要求:不超1500种,一品两规
医疗机构基本用药供应目录的品规数应控制在合理范围,原则上不超过1500个品规(不含协议期内国家医保目录中的谈判药品和专用于罕见病治疗的药品)。同一通用名称药品的品种,注射剂型和口服剂型各不得超过2种,处方组成类同的复方制剂1~2种,因特殊人群、疾病特殊诊疗需要使用其他剂型和剂量规格药品的情况除外。
各医疗机构应放宽对儿童适宜品种、剂型、规格(例如,法定说明书中明确适用于儿童的,其剂型为能够提高儿童用药顺应性的口服液体剂型、颗粒剂、口服散剂、栓剂、滴鼻剂等)的配备限制,满足儿科临床需求。
(三)抗菌药物管理:
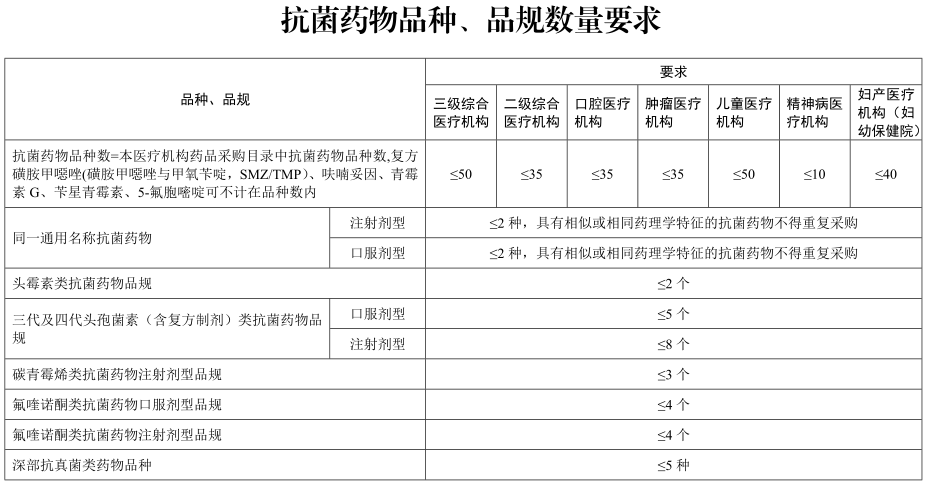
抗菌药物应按照原国家卫计委《关于进一步加强抗菌药物临床应用管理工作的通知》(国卫办医发〔2015342号)规定的品种、品规数量要求进行管理(附录1)。医疗机构确定的抗菌药物供应目录品种,应于遴选或调整后15个工作日内、抗菌药物临时采购情况应于每半年,向核发其《医疗机构执业许可证》的卫生健康行政部门备案。确因临床需要,抗菌药物品种和品规数量超过规定的,应当向该卫生健康行政部门申请,获得批准后方可使用。
(四)鼓励开展药品临床综合评价。鼓励有条件的医疗机构对药品临床使用的安全性、有效性、经济性等开展综合评价,并将评价结果作为本机构基本用药供应目录制定、遴选的依据。
医疗机构基本用药供应目录调整流程
(一)药品引进。
1.药品引进是指医疗机构根据临床需要,增加本机构基本用药供应目录以外的药品。引进药品为临床必需、使用安全、疗效确切,基本用药供应目录内没有同类药品或与基本用药供应目录内药品相比有一定优势的品种。医疗机构要建立规范的药品引进制度,确保工作流程公开、公正、透明。
2.各医疗机构应按照以上药品配备原则和品规数要求进行药品引进。对于临床优势明显、安全性高或临床急需、无可替代的国家医保谈判协议期内药品和新型抗肿瘤药等创新药物,医疗机构应当在充分评估的基础上,简化引进流程,及时纳入本机构基本用药供应目录。
( 二)药品调出:8种情况将被调出
药品调出原则。医疗机构使用的药品出现下列情况之一的,应调出本机构基本用药供应目录:
(1)药品生产企业或药品上市许可持有人被吊销药品生产许可证,或药品监督管理部门、卫生健康行政部门及医保部门等官方公布应停止使用的品种;
(2)在本医疗机构频繁发生与药品质量有关的严重不良反应的药品;
(3)出现明显质量问题,在验收、使用过程中多次被投诉,影响医疗安全的药品;
(4)经药事管理和药物治疗学委员会(组)论证,可被风险效益比或成本效益比更优的品种所替代的药品;
(5)违反有关规定,在本医疗机构的药品营销活动中有不良记录的品种;
(6)根据院感科、临床微生物室和药学部门联合发布的细菌耐药报告,对主要目标细菌耐药率均超过75%的抗菌药物;
(7)临床未使用超过1年的药品(不含罕见病用药);
(8)医疗机构药事管理与治疗学委员会认为应当调出的其他情况。
(三)药品临时替代。
1.药品临时替代是指医疗机构基本用药供应目录内品种发生短缺,药品生产企业或药品上市许可持有人或供应商因各种原因不能向医疗机构供应,且为基本用药供应目录内不可替代、临床必需的品种,医疗机构可按照《医疗机构短缺药品分类分级与替代使用技术指南》遴选替代药品并在临床暂时替代使用。调整基本用药供应目录中正常供应的药品(含品规、剂型、生产企业等),需按药品引进和调出程序执行。
2.临时替代药品的遴选应结合临床实际,原则上按照以下优先级进行:
(1)与该药品通用名相同的其他品种(例如,同生产企业不同规格剂型或相同规格剂型但生产企业不同) ;
(2)与该药品化学成分相同的其他药品;
(3)与该药品药理学作用分类相同的其他药品;
(4)与该药品临床诊疗效果相似的其他药品。
3.以下药品原则上不得临时替代:
(1)基本用药供应目录已有同类或相类似作用的品种;
(2) 列入国家、省重点监控药品目录内的品种;
(3)属于辅助性、营养性的药品品种,包括能量及营养成分补充药物、免疫增强剂、脑循环与促智药、活血化瘀类药物、抗肿瘤辅助用药等。
基本用药供应目录中原短缺药品恢复供应时,应停止替代药品的采购供应。对于连续6个月以上不能正常供应的品种,且替代药品在医疗机构使用安全有效、价格合理、供应稳定的,需经药事管理与药物治疗学委员会(组)审议,按药品引进和调出程序纳入医疗机构基本用药供应目录。
规范医疗机构药品采购工作
(一)加强药品供应保障。医疗机构应当根据医院功能定位,合理设置临床必须急(抢)救药品库存警戒线,及时采购补充。鼓励罕见病诊疗协作网医疗机构常规配备至少1人份的罕见病治疗药品,确保门诊患者用药需求。
(二)药品供应商选择。
1、医疗机构应在省、广州、深圳药品集中采购平台上选择药品供应商。医疗机构应遵循公开、公平、公正、质量优先的原则制定药品供应商遴选流程。医疗机构可优先选择药品生产企业或药品上市许可持有人出具“授权委托配送书”(盖生产企业公章)的供应商。
2、对某一具体品种,同一家医疗机构只能选择一个供应商,且在采购周期内原则上不再变更。如特殊情况确需要变更的,需报医疗机构药事管理与药物治疗学委员会主任委员审批。
(三)药品临时采购。
1.医疗机构原则上不得采购本机构基本用药供应目录以外的药品。临时采购仅限于临床治疗必需、而本机构现有基本用药供应目录的药品无法提供有效治疗的情况,例如:目录内药品发生短缺、临床急抢救、外院会诊专家建议使用、特殊患者特需的目录外药品或专科药物等。
2.不得临时采购本机构基本用药供应目录已有同类或相类似作用的品种、重点监控药品和辅助性药物(包括能量及营养成分补充药物、免疫增强剂、脑循环与促智药、活血化瘀类药物、抗肿瘤辅助用药等)等临床非紧急、非必需的药品。
3.基本用药供应目录内品种发生短缺时启动临时采购程序按照药品替代程序执行,其他临时采购药品的数量必须严格控制,原则上不得超过一个患者按照药品说明书推荐的一个疗程的用量;协议期内国谈药品,医疗机构须建立绿色通道,根据医疗机构的诊疗范围,及时启动临时采购程序,并简化药品引进程序,尽快纳入基本用药供应目录。
意见稿还指出,对于国家、省药品集中采购等政策原因,导致上述规则无法涵盖的,而相关政策要求需要按时执行等情况,医疗机构药学部门应及时书面上报药事管理与药物治疗学委员会主任委员审批,由主任委员事先决定执行流程,不能由药学部门先执行后报药事管理与药物治疗学委员会备案。
|