|
摘要
abstract
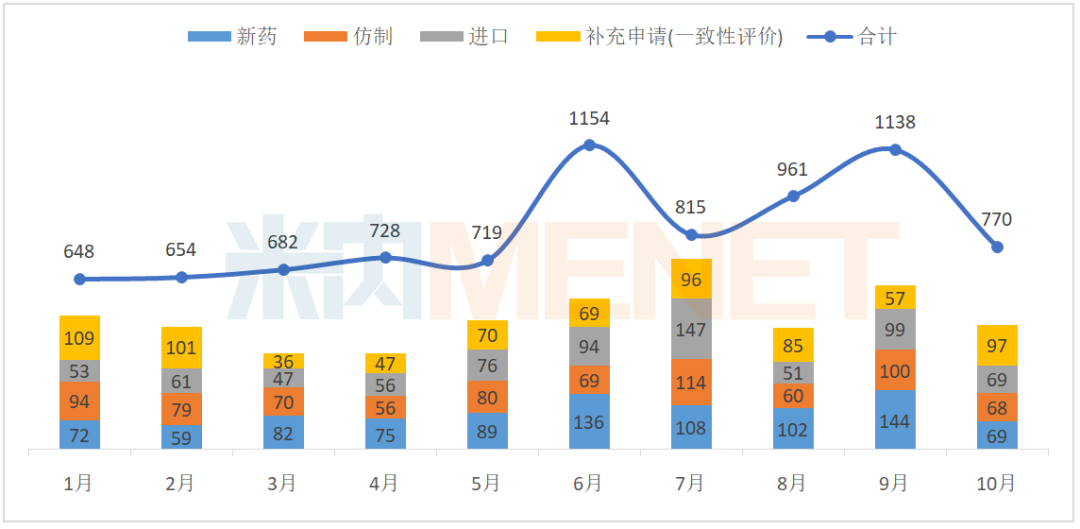
10月CDE共承办药品注册申请770件
12个品种首次有企业申报一致性评价
2个重磅1类新药申报上市
仿制申请中有2个品种为首家仿制申报
信达生物利妥昔单抗生物类似药获批
3个首仿品种获批
CDE总体承办情况
据MED中国药品审评数据库2.0统计,2020年10月CDE共承办药品注册申请770件。
2020年1-10月CDE承办药品注册申请情况(按受理号计)
一致性评价补充申请承办情况
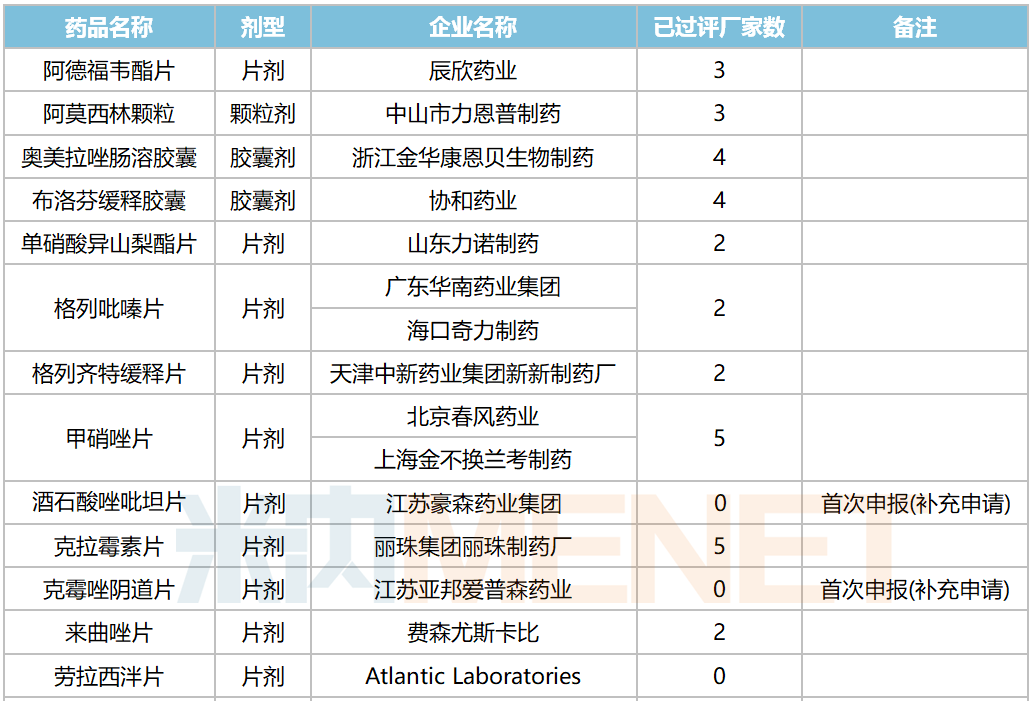
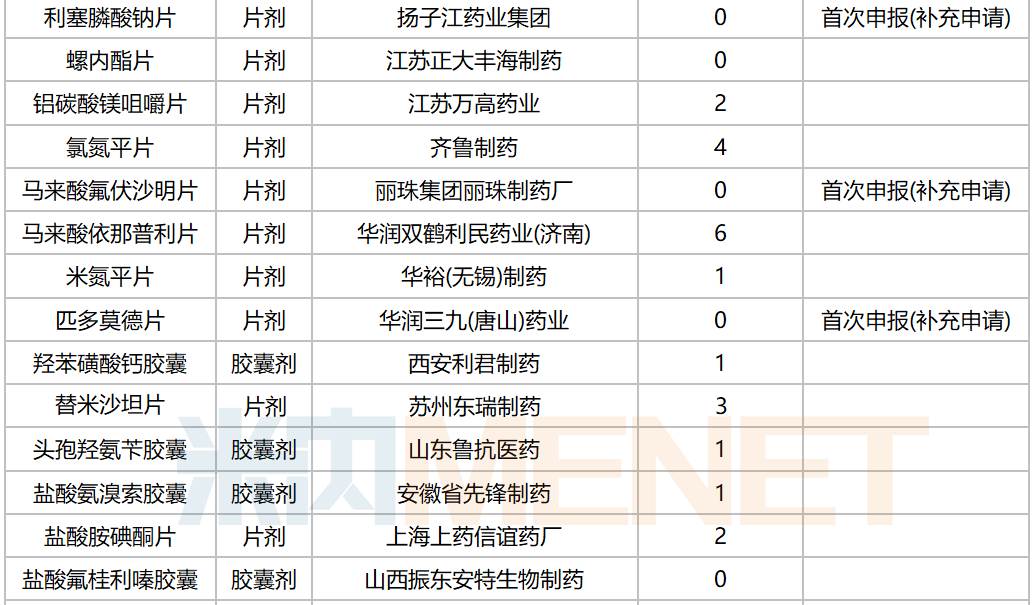
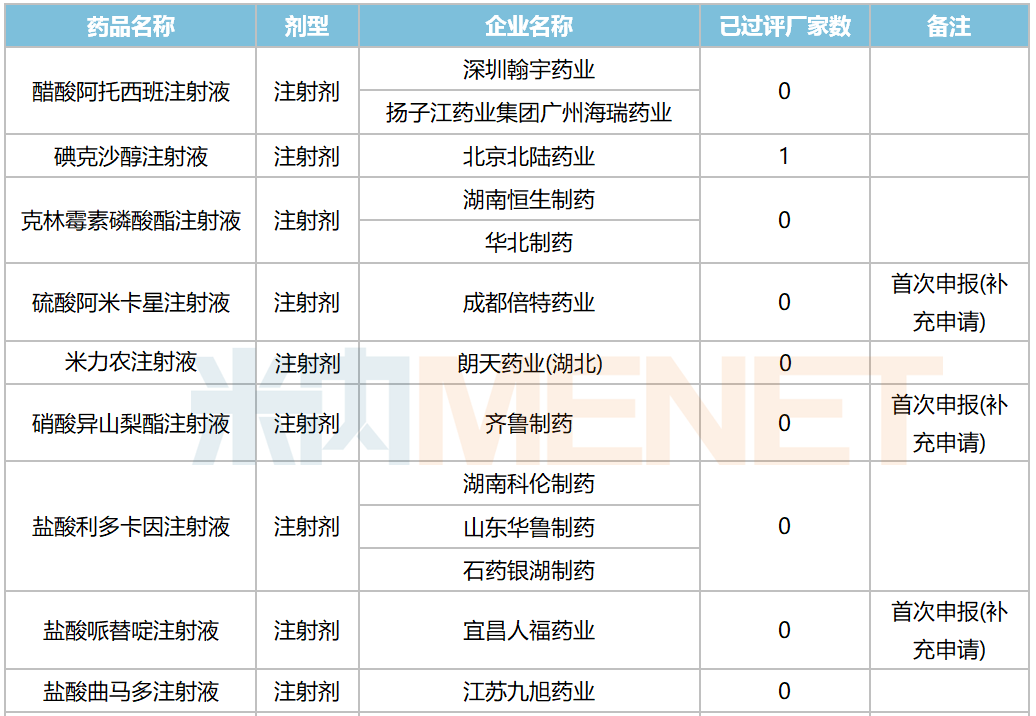
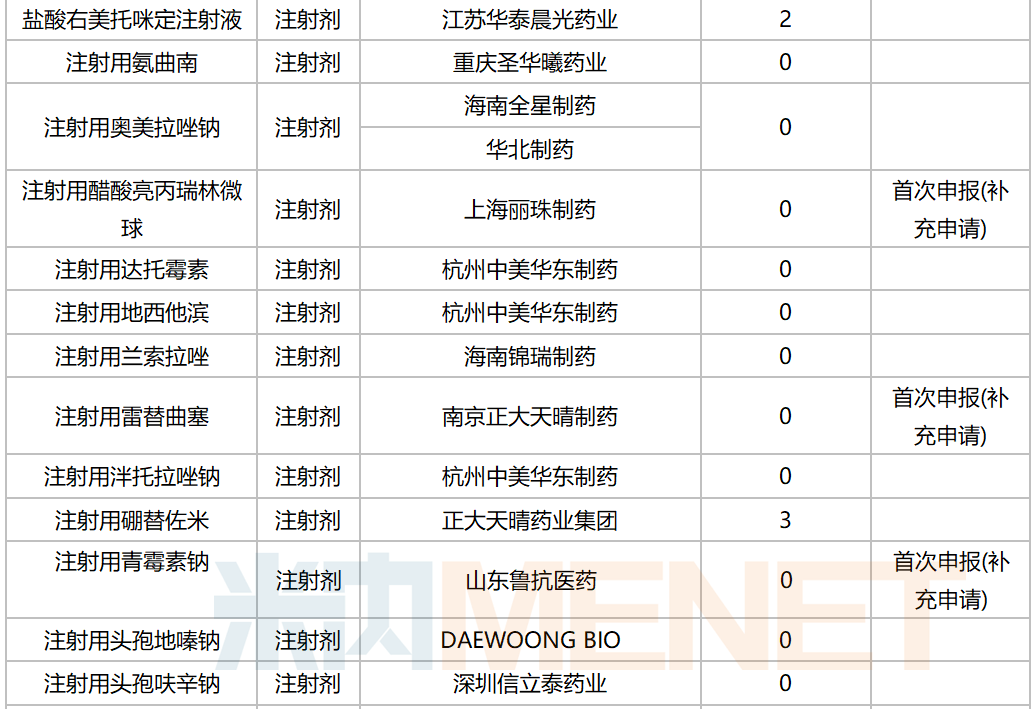
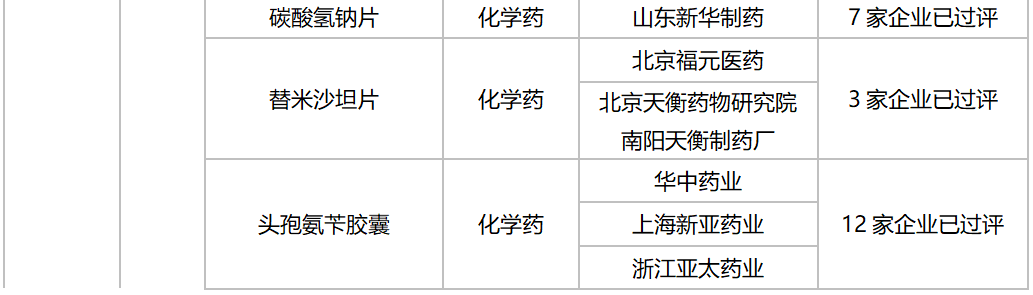
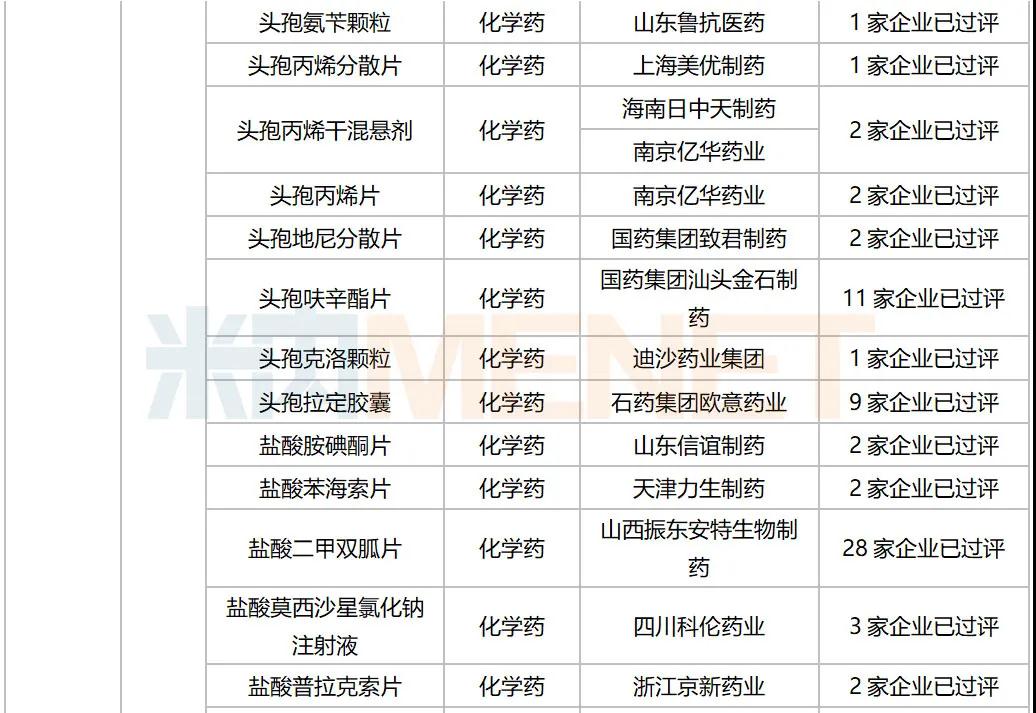
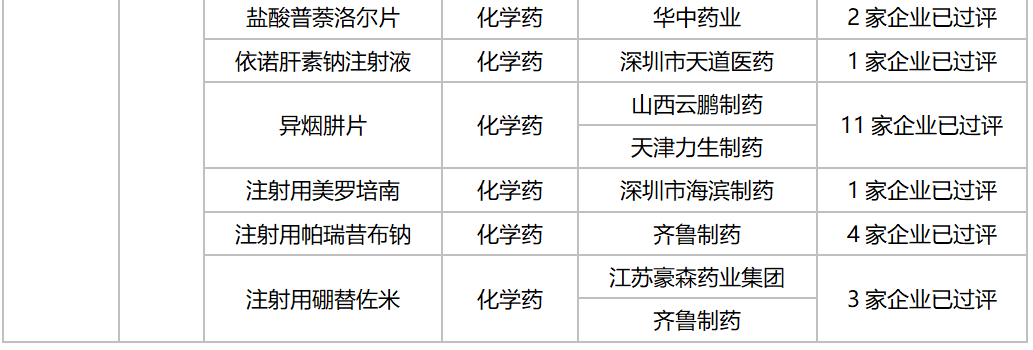
10月,58个品种的一致性评价补充申请获CDE承办。其中口服制剂品种有32个,注射剂品种有26个,12个品种为首次有企业申报一致性评价,杭州中美华东制药(注射用达托霉素,注射用地西他滨,注射用泮托拉唑钠)和齐鲁制药(氯氮平片,硝酸异山梨酯注射液,佐匹克隆片)均有三个品种启动一致性评价。详细情况见下表:
2020年10月CDE补充申请(一致性评价)口服制剂品种承办情况
2020年10月CDE补充申请(一致性评价)注射剂品种承办情况
新药申请承办情况
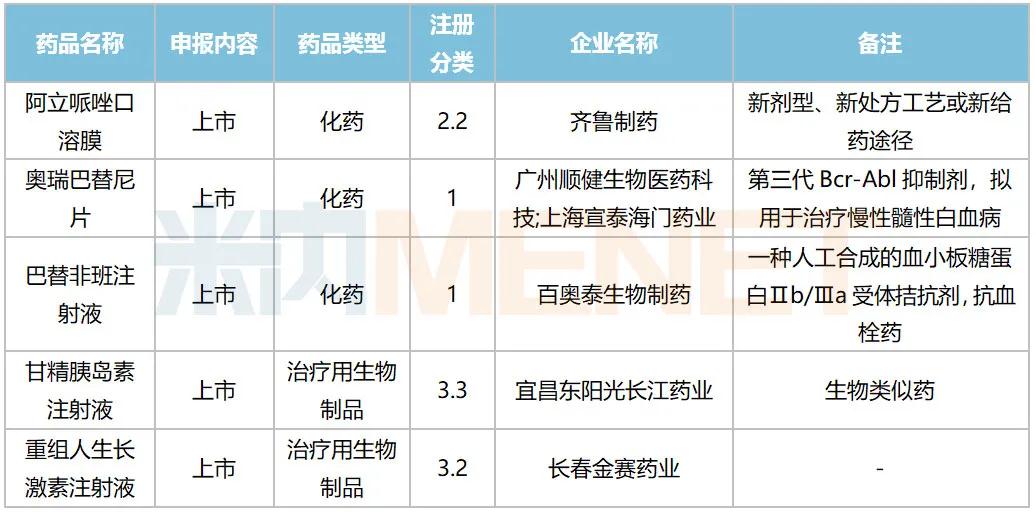
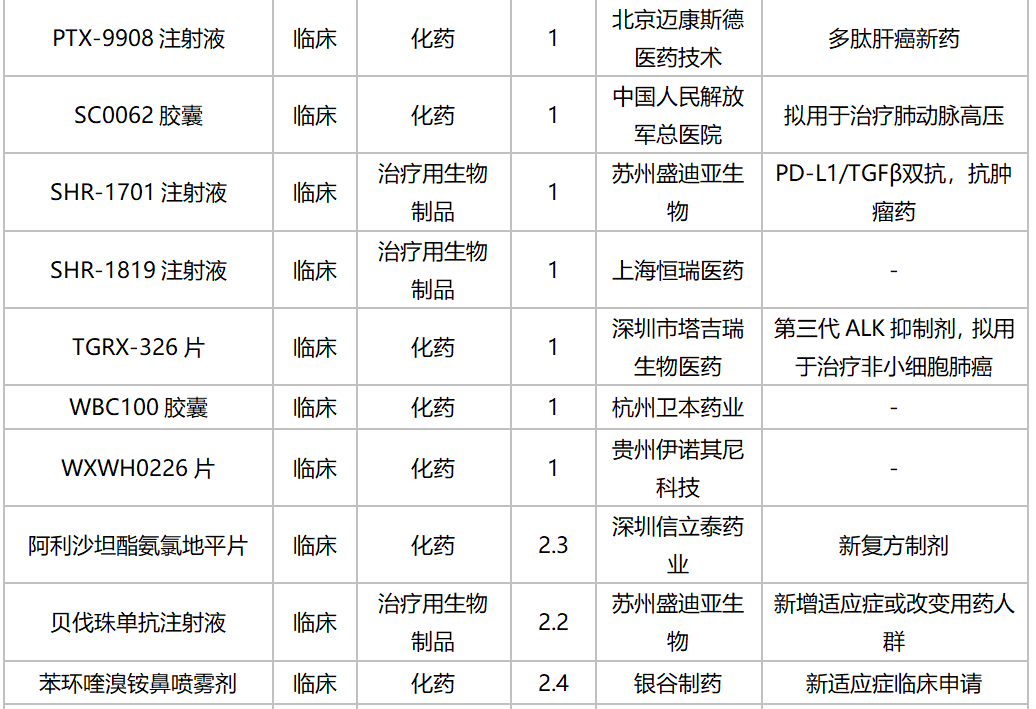
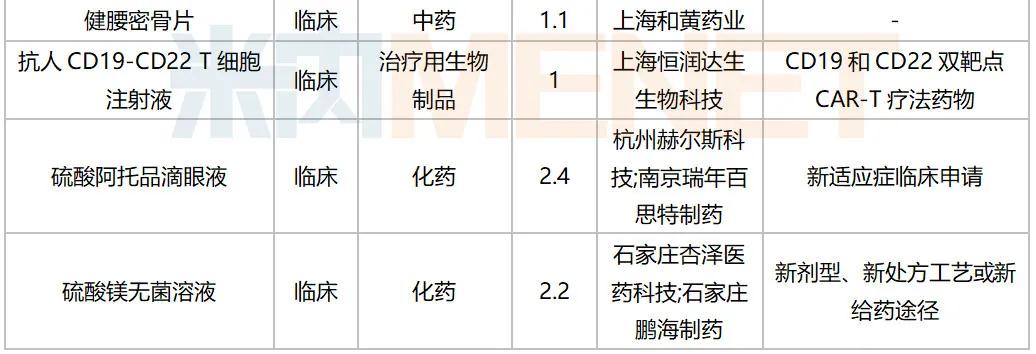
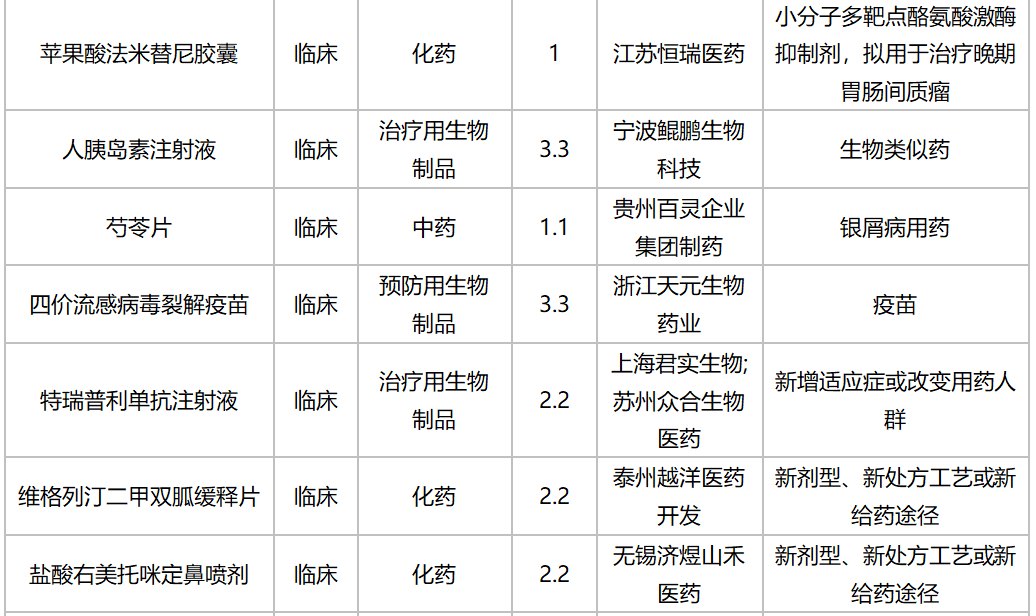
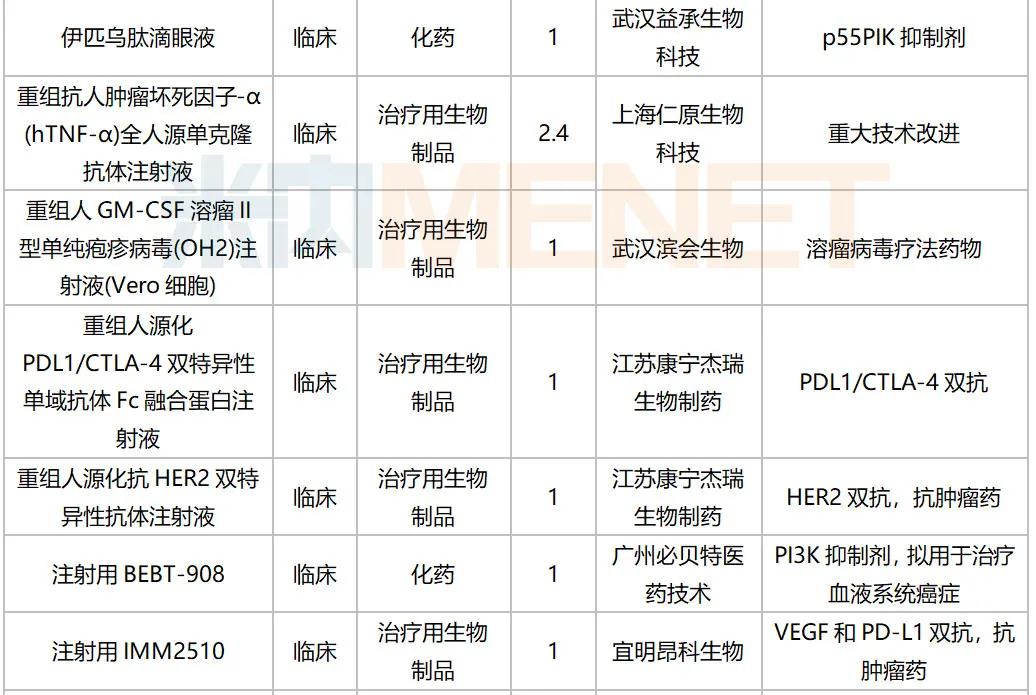
10月,52个品种的新药申请获CDE承办,属于1类新药的有35个;2类改良型新药的有13个;此外还有2个3.3类生物类似药。广州顺健生物和上海宣泰海门药业联合提交奥瑞巴替尼片上市申请,百奥泰生物提交巴替非班注射液上市申请,宜昌东阳光长江药业提交甘精胰岛素生物类似药上市申请。详细情况见下表:
2020年10月国内新药上市申请承办情况
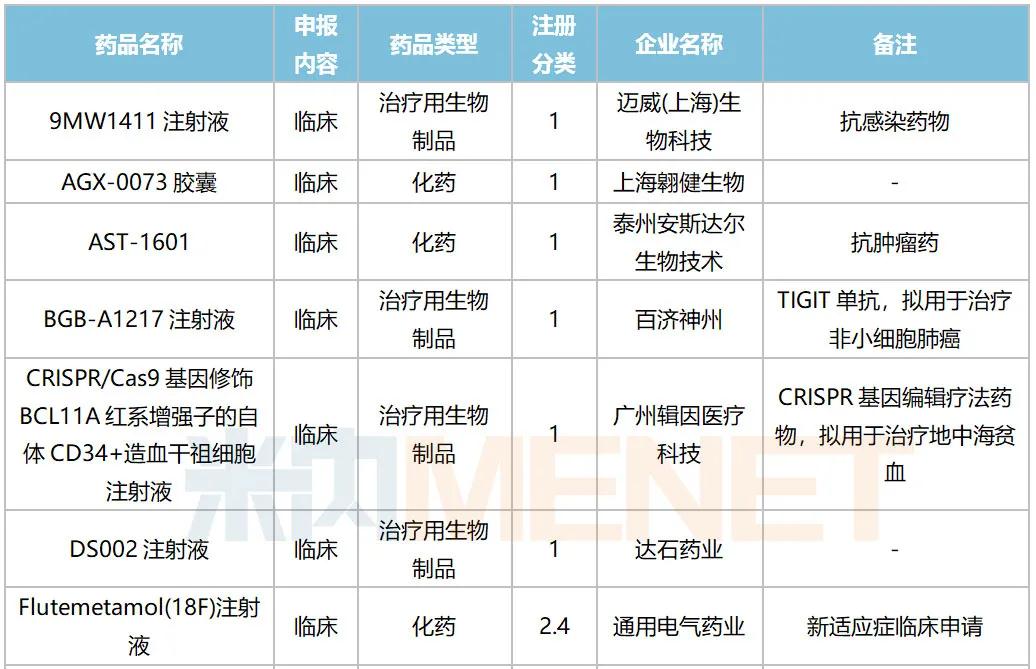
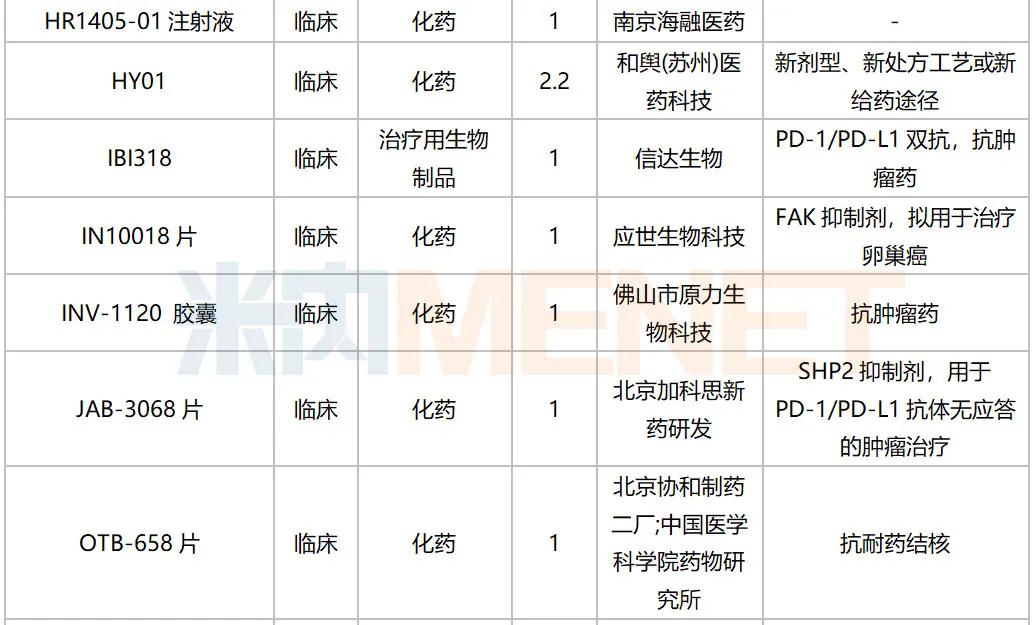
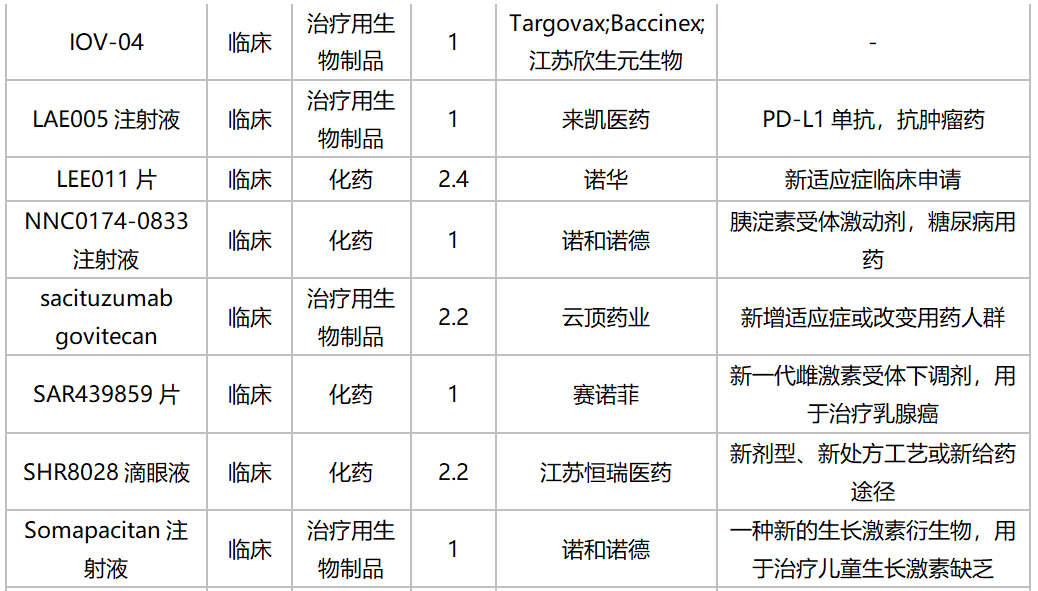
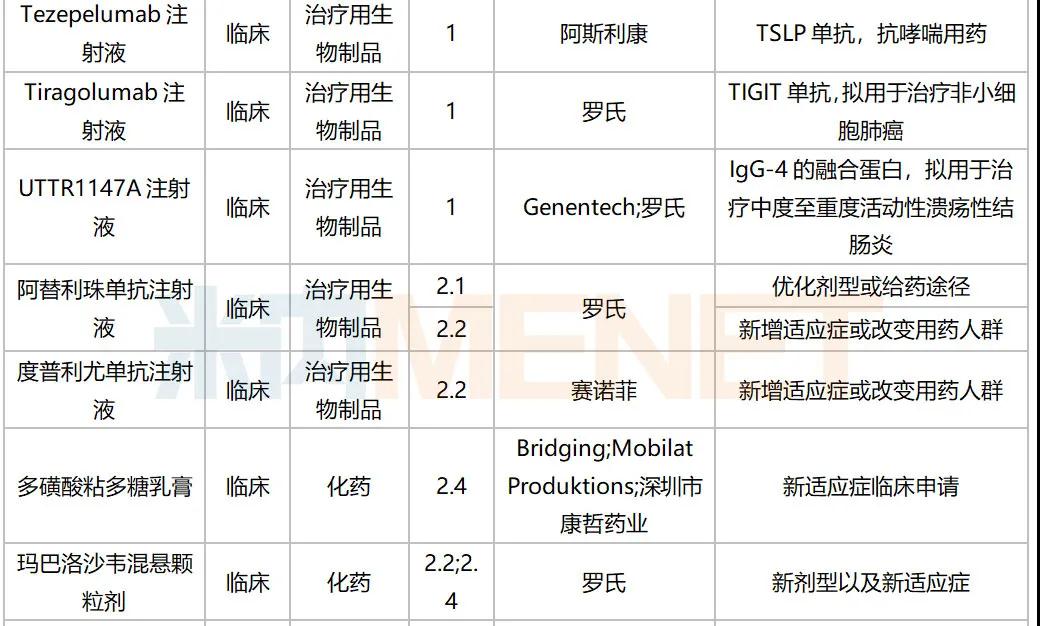
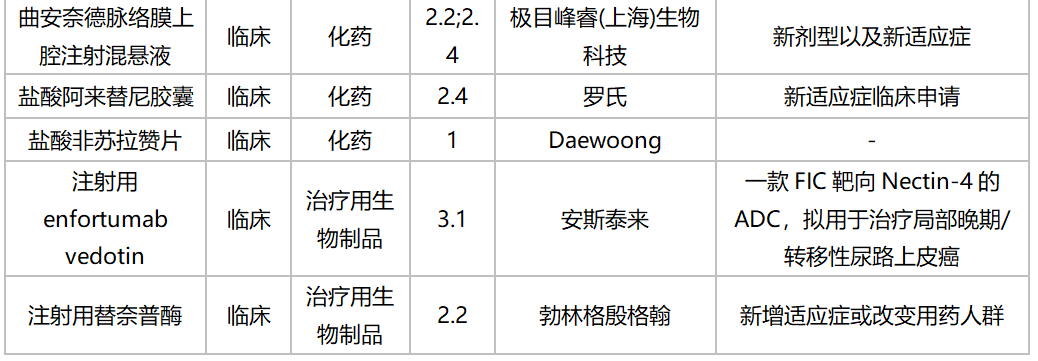
2020年10月国内新药临床申请承办情况
仿制申请承办情况
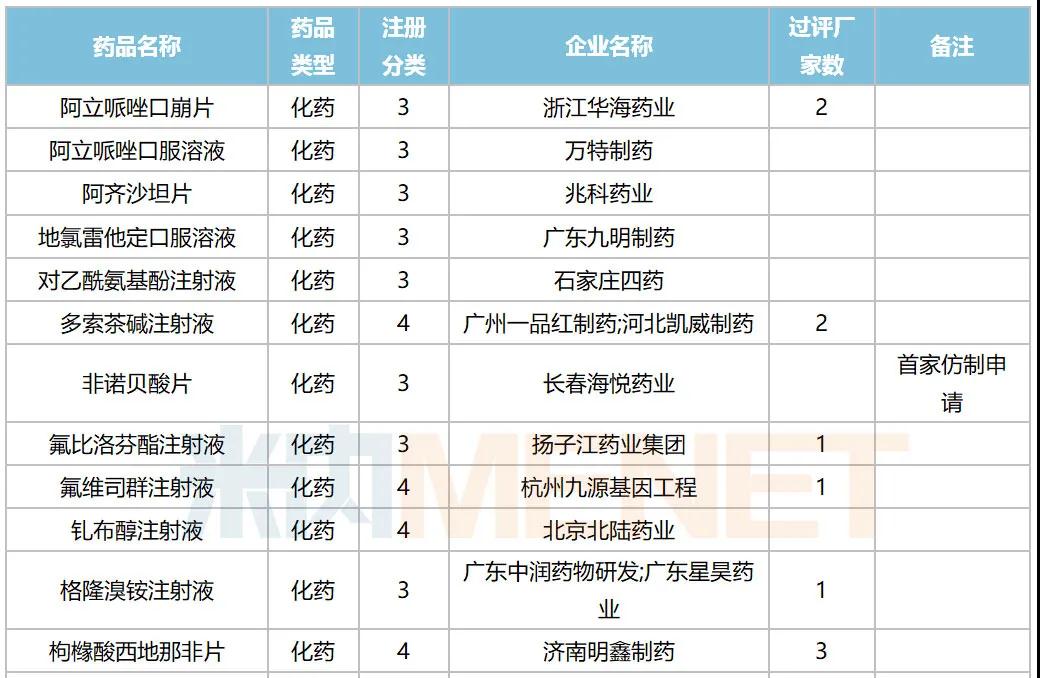
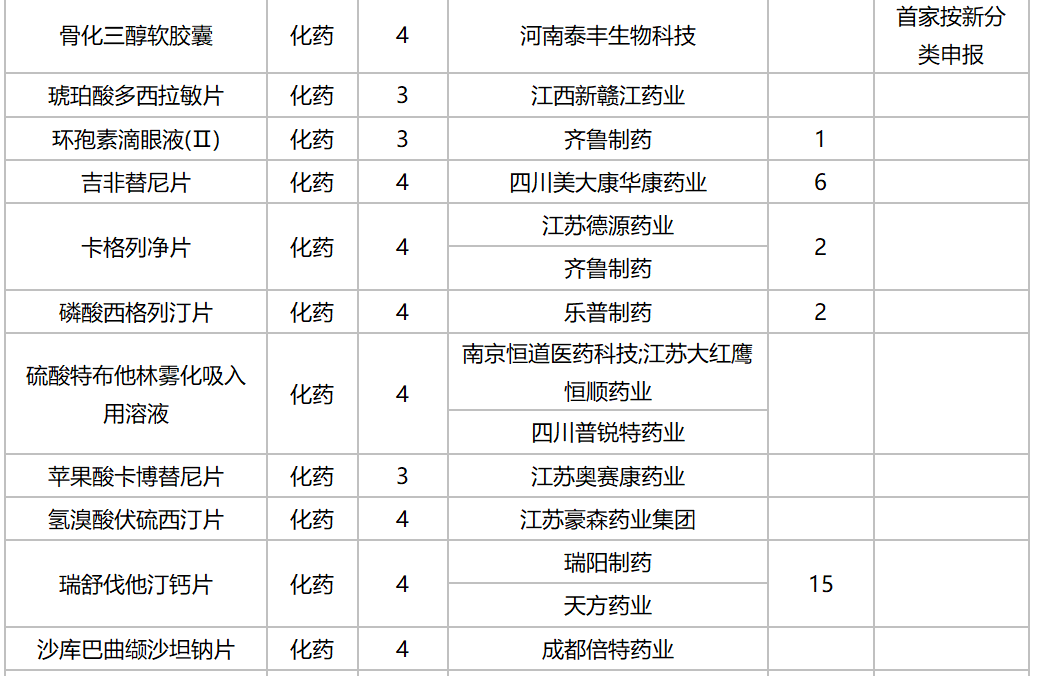
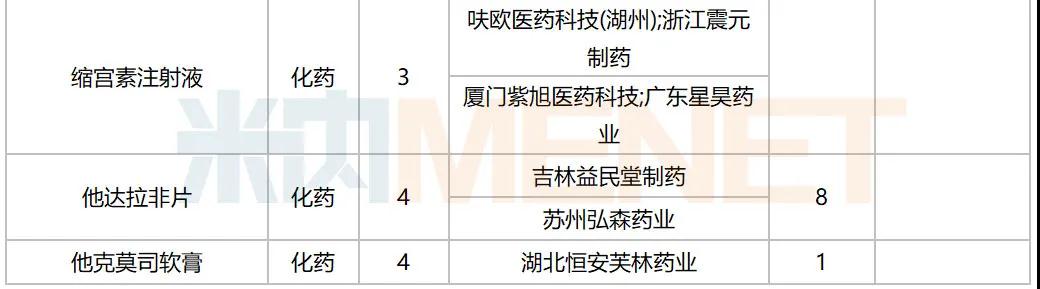
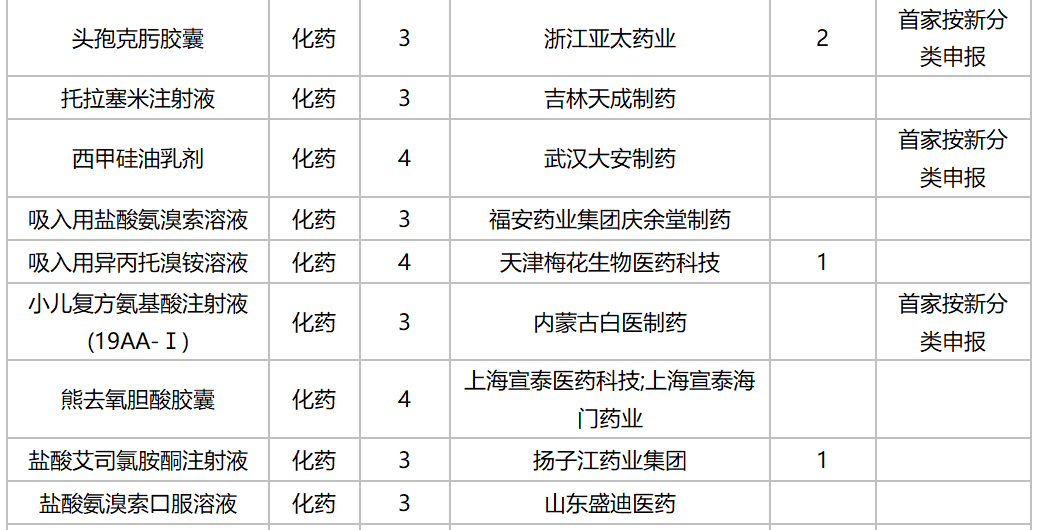
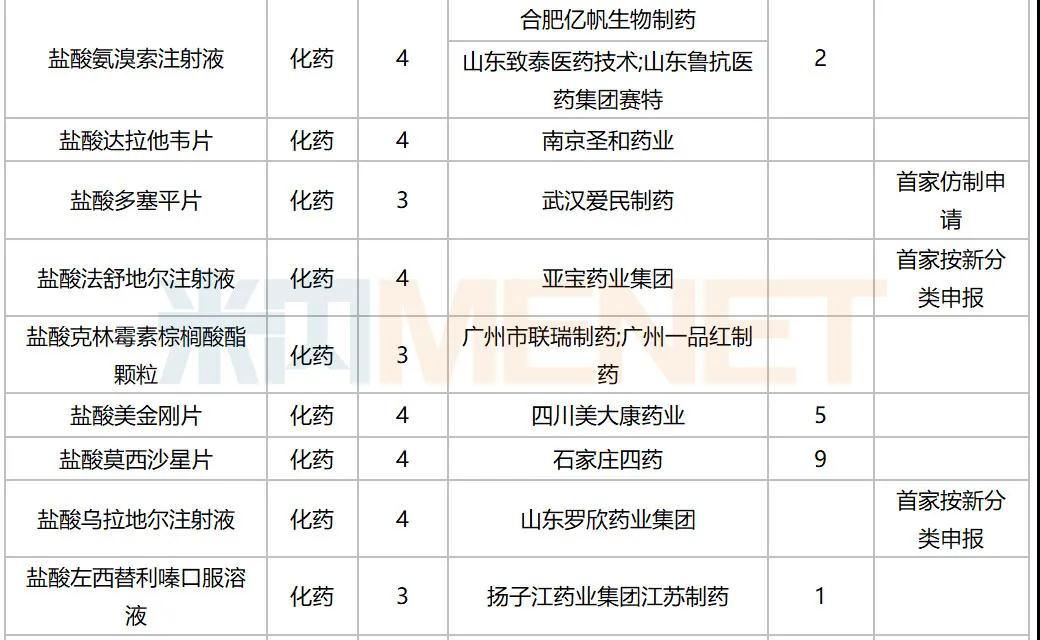
10月,47个品种的仿制申请获CDE承办,其中按3类申报的有21个,按4类申报的有26个;非诺贝酸片(长春海悦药业)以及盐酸多塞平片(武汉爱民制药)为首仿申请。详细情况见下表:
2020年10月国内仿制申请承办情况
进口申请承办情况
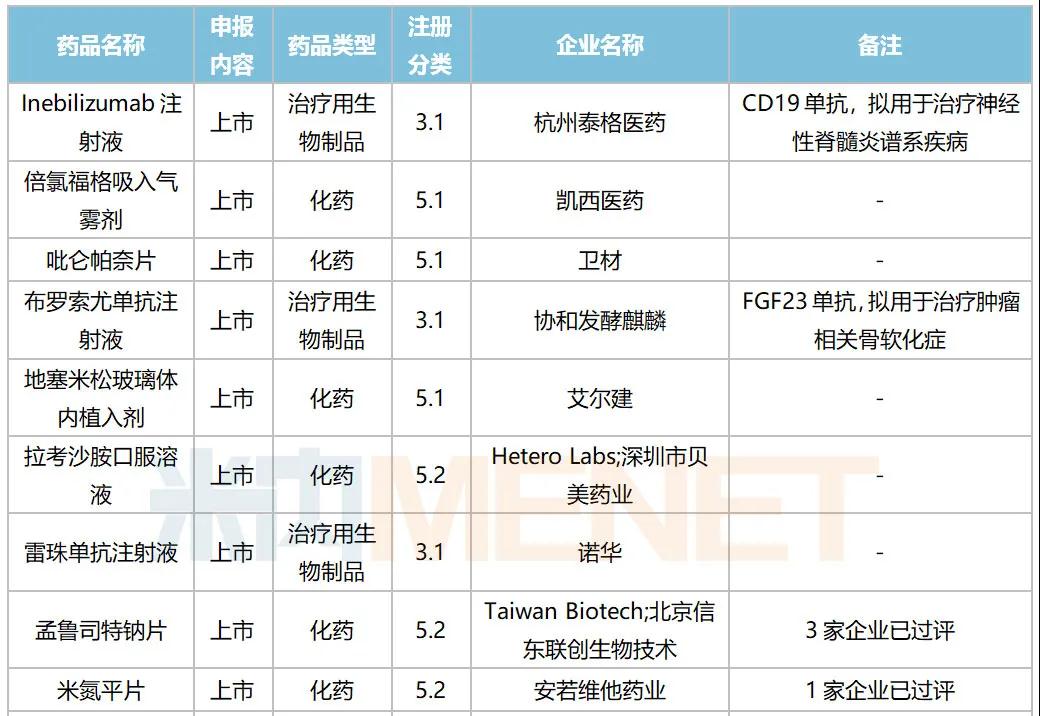
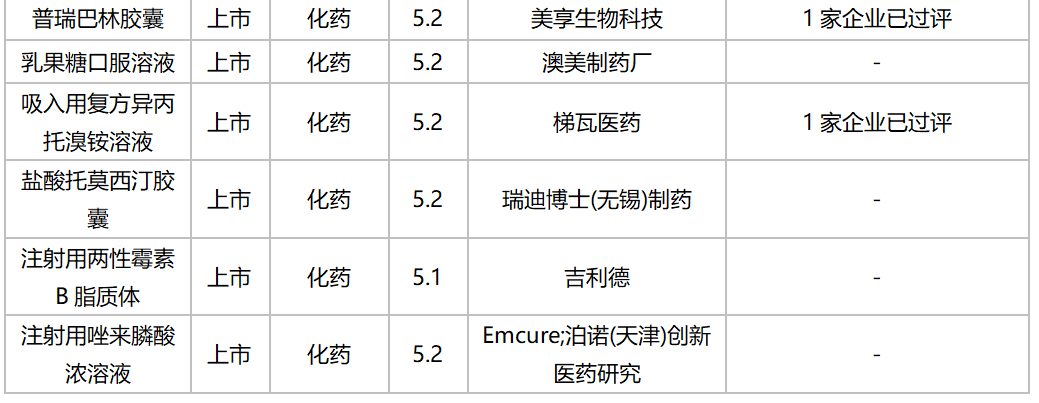
10月,41个品种的进口申请获CDE承办,其中1类新药有12个;2类改良型新药有14个,5.1类进口原研药4个,5.2类进口仿制药8个。详细情况见下表:
2020年10月进口上市申请承办情况
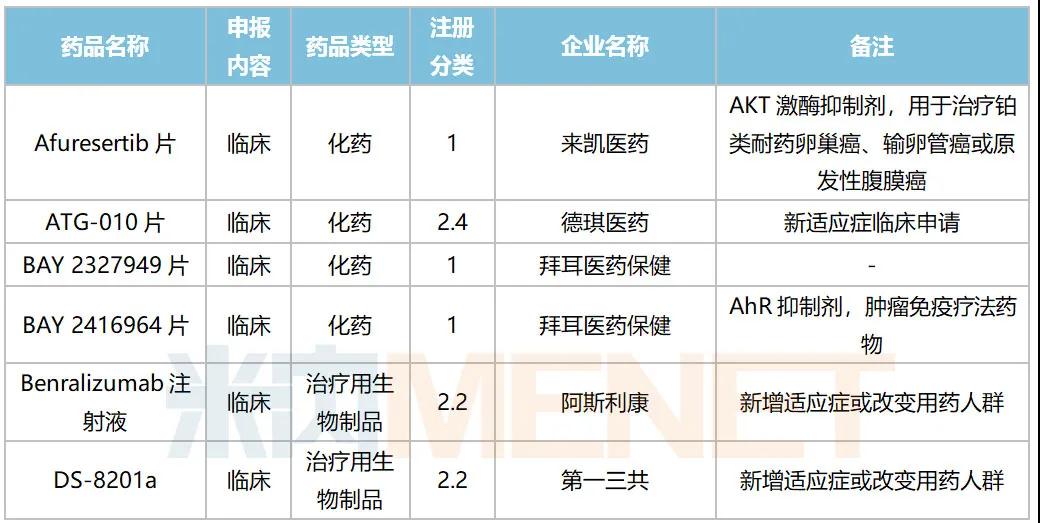
2020年10月进口临床申请承办情况
获批情况
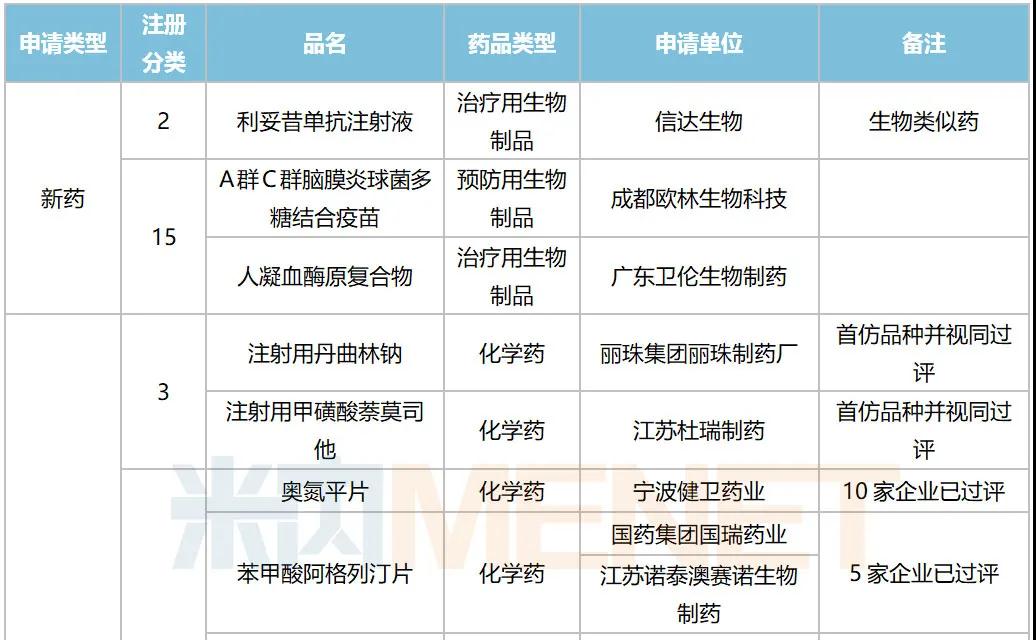
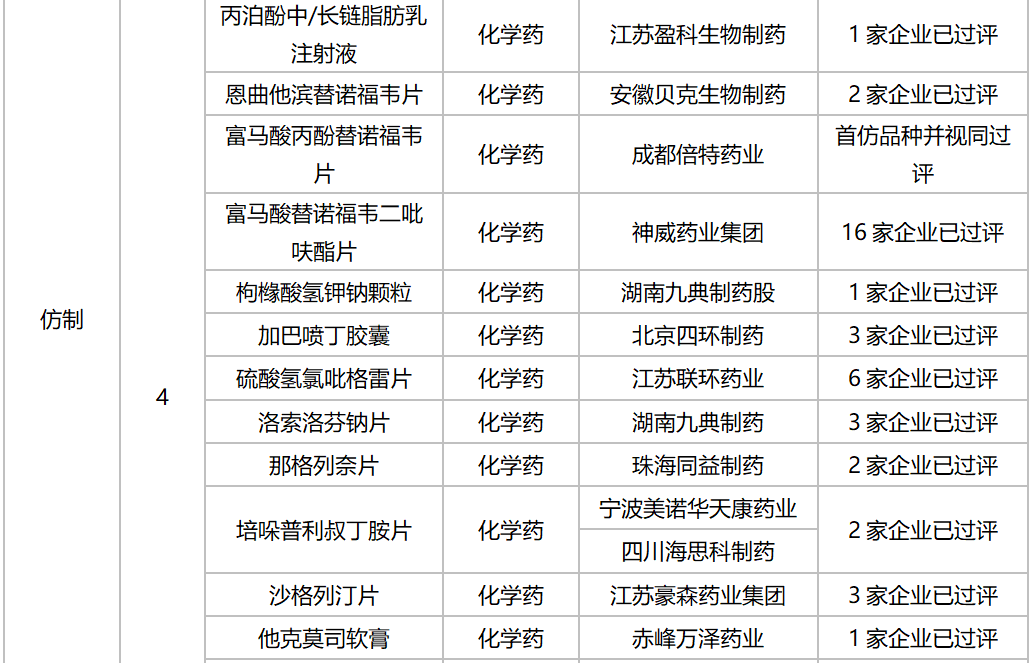
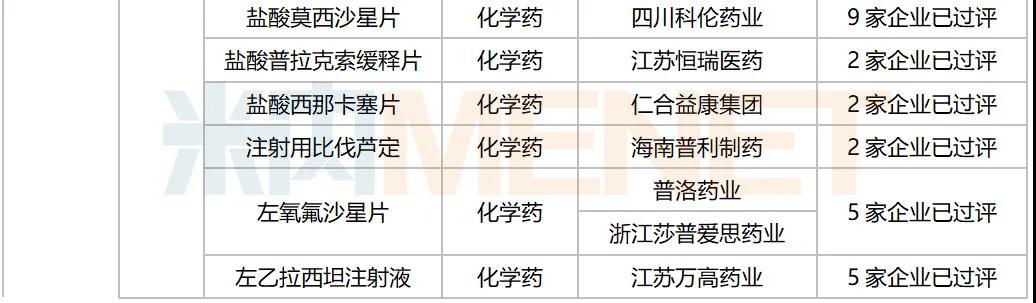
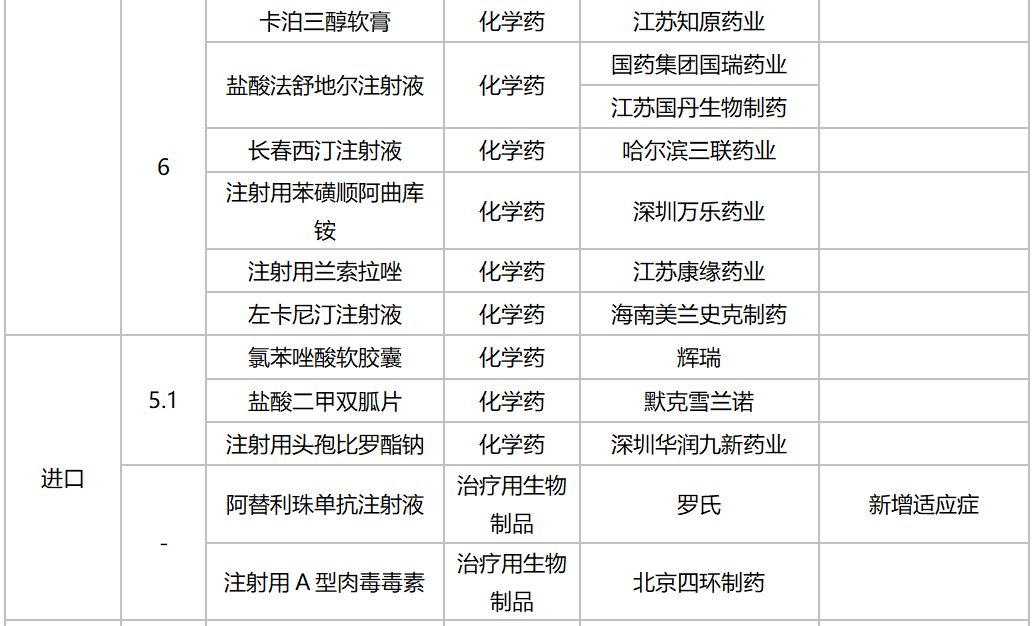
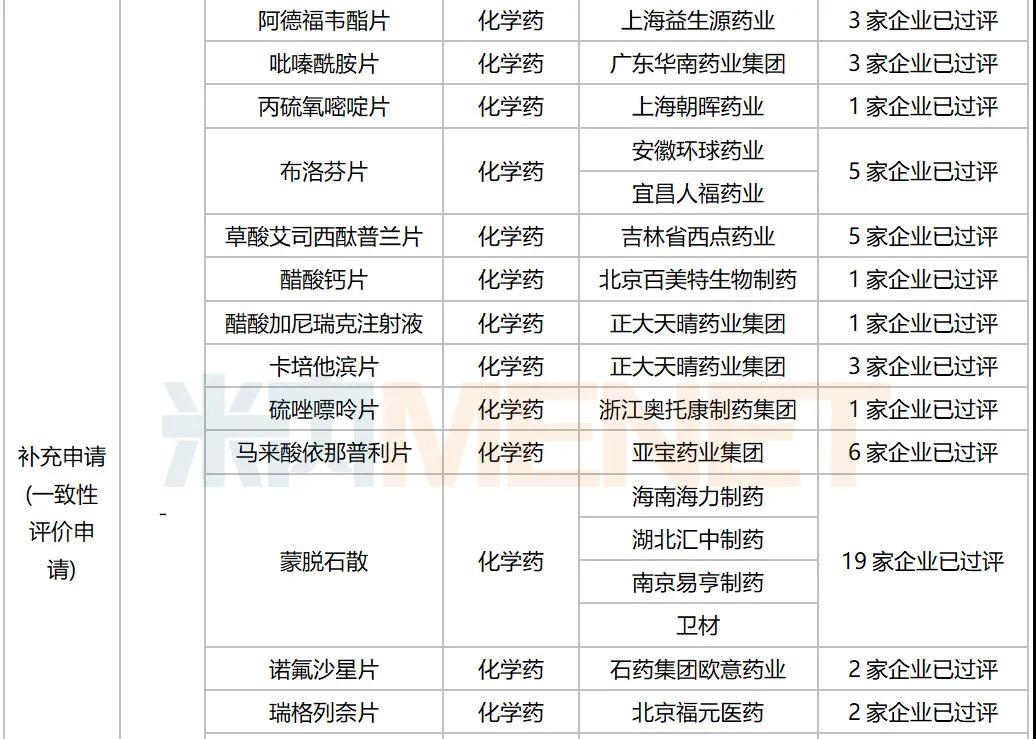
据MED中国药品审评数据库2.0统计,10月有多个重磅生物制品以及首仿品种获批:信达生物利妥昔单抗生物类似药获批上市,罗氏阿替利珠单抗注射液新适应症获批。注射用丹曲林钠(丽珠集团丽珠制药厂)、注射用甲磺酸萘莫司他(江苏杜瑞制药)、富马酸丙酚替诺福韦片(成都倍特药业)为首仿获批。详细情况见下表:
2020年10月部分品种获批情况
数据来源:米内网MED药品审评数据库2.0、CDE、NMPA;数据统计截至2020年10月31日,相关统计字段按药品名称统计;药物作用靶点以及适应症来自公开资料,如有疏漏,欢迎指正。
|