|
大部分人对CAR-T疗法的认知。
一是因为其神奇的治愈能力,被常常提起的是世界上首位被CAR-T疗法“治愈”的儿童:Emily Whitehead的故事。Emily Whitehead曾在社交平台上晒出了照片,宣告自己已无癌生存9年。

二是因为“120万一针的抗癌神药”的名头。
2017年,由诺华研发的CAR-T细胞疗法Kymirah被美国FDA批准上市,这是全球首个获批的CAR-T细胞疗法。
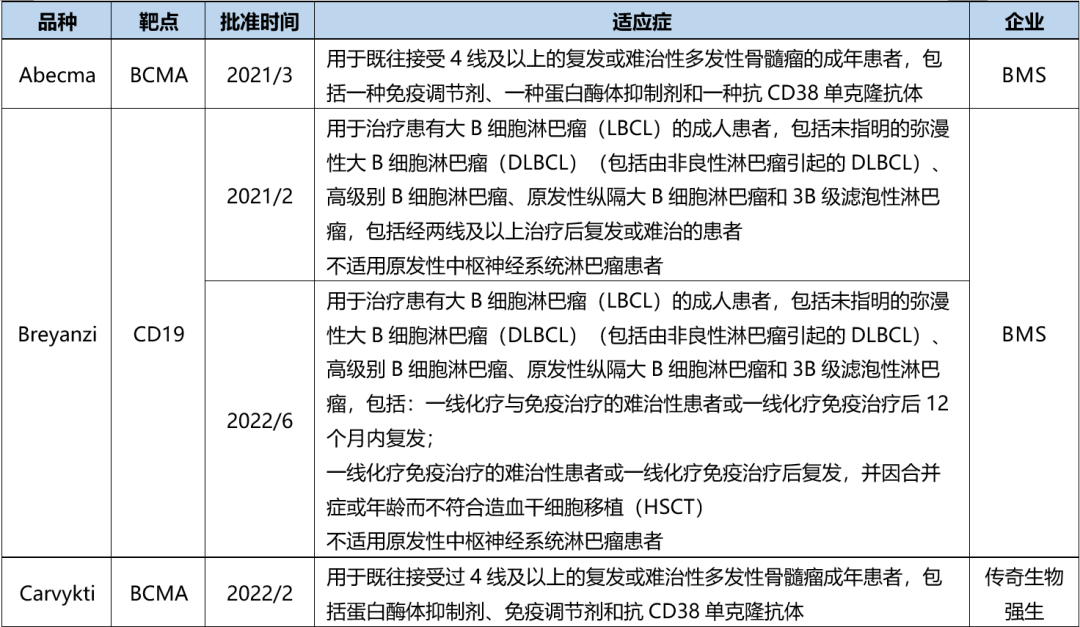
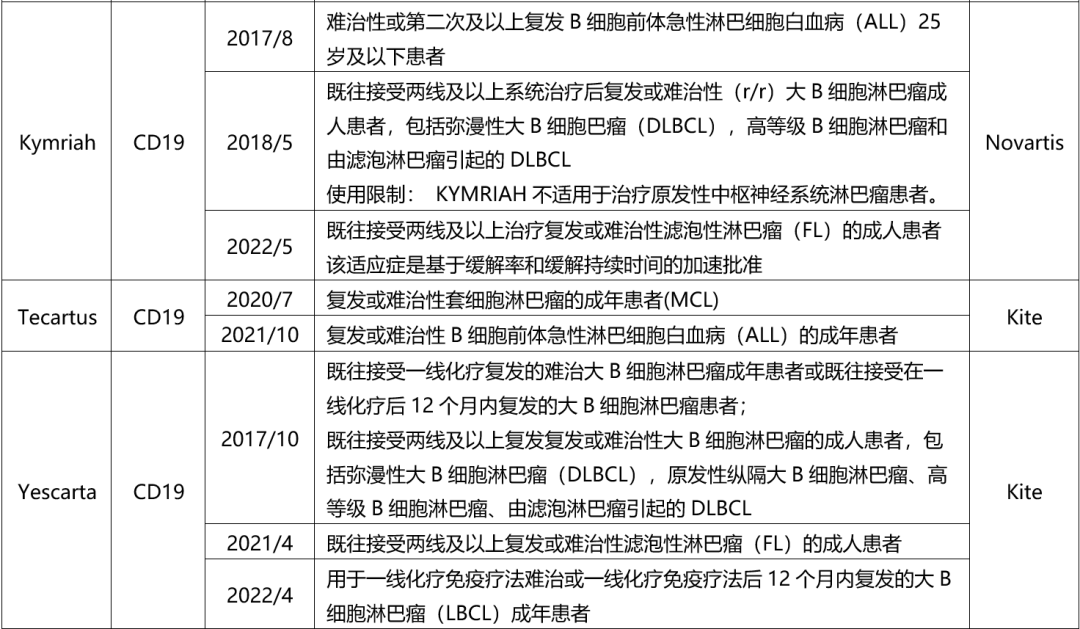
目前FDA共批准了6款CAR-T产品,2个靶点为BCMA、4个为CD19,均为自体CAR-T。
表 FDA批准CAR-T产品(截至2023年6月30日)
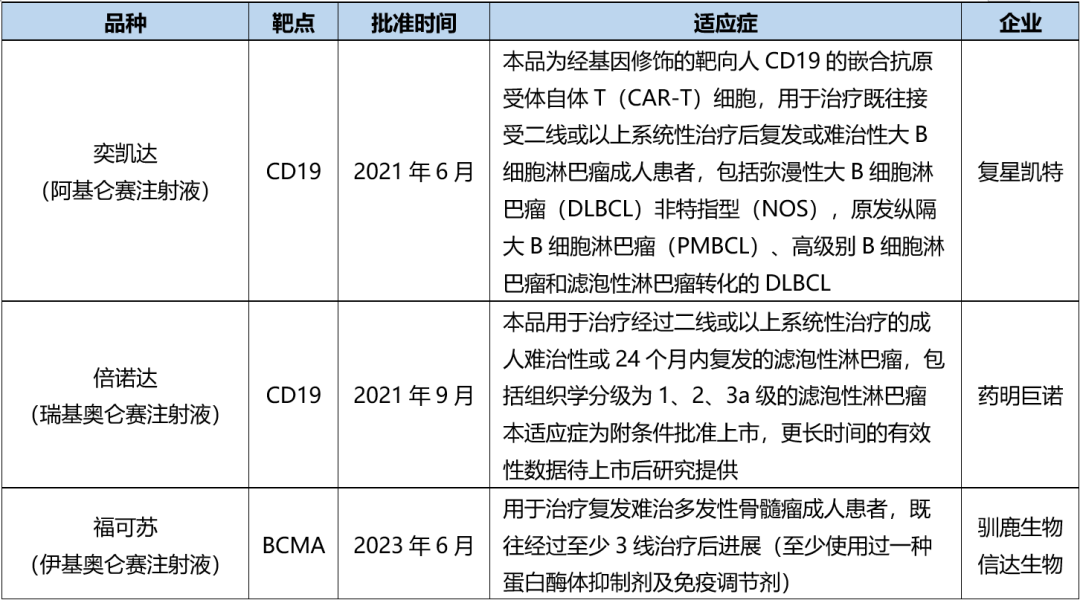
NMPA批准了3款,其中复星凯特的产品来自美国Kite。驯鹿生物靶点为BCMA,其余2款靶点为CD19,均为自体CAR-T。
表 NMPA批准CAR-T产品(截至2023年6月30日)
1、Kymirah(Tisagenlecleucel)
全球首个上市的CAR-T细胞疗法,被FDA批准用于治疗25岁以下、难治性或两次或多次复发的B细胞前体急性淋巴细胞白血病(B-ALL)患者。Kymirah靶向CD19,这也是目前被认为对于ALL最为有效的靶点。
该疗法的批准是基于一项全球多中心的单臂II期ELIANA研究,63名接受疗效评估的患者中显示83%(52/63;95%CI:71%-91%)在接受输注的三个月内达到了完全缓解(CR)或显示血细胞计数未完全恢复的CR(CRi)。
2018年5月,美国食品和药物管理局批准Tisagenlecleucel用于治疗2线以上的成人DLBCL患者,基于 JULIET研究的数据获批。
2、Yescarta(Axicabtagene)
2022年6月28日,吉利德宣布欧盟委员会(EC)已批准其CAR-T细胞疗法Yescarta,用于治疗经过三种或更多线全身治疗后复发或难治性滤泡性淋巴瘤(FL)的成年患者。
在美国,Yescarta于2021年3月获得加速批准成为第一款治疗FL的CAR-T细胞疗法,其具体适应症为:用于治疗二线或以上系统治疗后的R/R FL成人患者。此前,美国FDA已授予Yescarta治疗FL的突破性药物资格。
Yescarta首个适应症于2018年8月获批:用于治疗二线或以上系统治疗后的复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)和原发性纵膈B细胞淋巴瘤(PMBCL)成人患者。
该药物靶向CD19,其获批源于ZUMA-1临床试验,验证了101名患者中72%的总缓解率以及尚可控的不良反应。
3、Tecartus(Brexucabtagene Autoleucel)
Tecartus是一种CD-19导向的转基因自体T细胞免疫疗法,通过将患者自身血液中提取的T细胞改装成有活性的,能识别CD-19抗原的CAR-T细胞,并将改装好的T细胞经静脉回输到患者体内,治疗复发或难治性套细胞淋巴瘤和前体B细胞急性淋巴细胞白血病。
Tecartus回输后在体内活化和迅速扩增,可结合表面有CD-19抗原的癌细胞以及正常的B细胞。
研究表明,在抗CD-19 CAR-T细胞与表达CD-19的靶细胞结合后,CD28和CD3-zeta共刺激域激活下游信号级联,从而引发T细胞激活、增殖、获得效应功能、炎症细胞因子和趋化因子的分泌等一些列反应,最终消灭表面有CD-19抗原表达的细胞。
同由吉利德研发的Tecartus,被批准治疗复发/难治性套细胞淋巴瘤(MCL)成人患者,此外还获批用于治疗复发或难治性B细胞急性淋巴细胞白血病(B-ALL)成年患者。两项适应症的获批分别基于ZUMA-2和ZUMA-3临床试验,18岁以上的MCL成人患者和复发或难治性B-ALL成人患者都取得了令人满意的缓解率。
4、Abecma(Idecabtagene Vicleucel)
由BMS与蓝鸟生物联合研发的Abecma于2021年3月被FDA批准用于治疗复发性/难治性多发性骨髓瘤(R/R MM)成人患者(既往接受过4种或更多种疗法,包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体),成为全球首个上市的BCMA导向CAR-T细胞疗法。
Abecma是一种首创(first-in-class)、BCMA导向、个体化免疫细胞疗法。BCMA是一种几乎普遍在多发性骨髓瘤癌细胞上表达的蛋白质。作为一种抗BCMA CAR-T细胞疗法,Abecma识别并结合BCMA,导致表达BCMA的细胞死亡。
在关键性Karmma试验中,在接受单次注射后,72%患者获得了持久的缓解,此外,该药物具有良好的安全性,细胞因子释放综合征(CRS)和神经系统毒性(NT)的发生可控且低级别。
5、Breyanzi(Lisocabtagene Maraleucel,liso-cel)
2021年FDA批准用于治疗复发或难治性大B细胞淋巴瘤(R/R LBCL)成人患者(先前已接受过2种或2种以上系统疗法),包括未另行说明的弥漫性大B细胞淋巴瘤(包括由惰性淋巴瘤引起的弥漫性大B细胞淋巴瘤)、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和滤泡性3B淋巴瘤。
Breyanzi是一种CD19的定向嵌合抗原受体(CAR-T)疗法,作为确定的组合物给药,以减少CD8和CD4成分剂量的可变性。Breyanzi具有4-1BB共刺激域,可增强 CAR T 细胞的扩增和持久性。
Breyanzi被FDA授予孤儿药、再生医学先进疗法和突破性疗法的称号。
6、Carvykti(西达基奥仑赛)
Carvykti 是传奇生物首款获批上市的产品,于2022年2月被FDA批准用于复发或难治性多发性骨髓瘤(R/R MM)患者(既往接受过四线或以上的治疗,包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)。
Carvykti 是一款具有两种靶向B细胞成熟抗原(BCMA)单域抗体的嵌合抗原受体 (CAR) T细胞免疫疗法。临床1b/2期 CARTITUDE-1研究结果显示既往接受过四线或者以上治疗R/R MM患者达到了高达98%的总缓解率,因此Carvykti获得FDA批准上市。
7、奕凯达(阿基仑赛注射液)
奕凯达是我国首个获批上市的CAR-T细胞疗法,由复星凯特引进美国Kite的Yescarta进行技术转移并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品,也是当初引起轰动的一针120万的“肿瘤神药”。
该药物获批用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤(r/r LBCL)成人患者。复星凯特开展的一项单臂、开放性、多中心桥接临床研究数据证明奕凯达与Yescarta安全性与有效性数据高度相似,也因此获得NMPA批准上市。
8、倍诺达(瑞基奥仑赛注射液)
倍诺达是首款我国独立自主开发的CAR-T细胞疗法,由药明巨诺研发,同时获得“重大新药创制”专项、优先审评和突破性治疗药物三项殊荣的已获批CAR-T产品。
2021年9月3日,首个一类新药CAR-T产品瑞基奥仑赛注射液获中国国家药品监督管理局(NMPA)批准上市,用于治疗经过二线或以上全身性治疗后成人患者的复发或难治性(R/R)大B细胞淋巴瘤(LBCL),瑞基奥仑赛注射液也成为全球第六个获批的CAR-T产品。
该药物也靶向CD19,其获批基于单臂、多中心、关键性研究(RELIANCE研究)的结果,入组了28例接受了包括CD20靶向药物和蒽环类药物的至少二线治疗后失败的r/r FL患者,在27例可评估有效性的患者中,3个月完全缓解率(CRR)和客观缓解率(ORR)分别为85.19%及100%,最佳完全缓解率和客观缓解率分别为92.6%及100%;在28例接受治疗的患者中,任何级别的细胞因子释放综合征(CRS)及神经毒性(NT)的发生率分别为42.9%及17.9%,≥3级CRS和NT的发生率分别为0%及3.6%。其显示了具有持续的缓解率与可控的药物毒性。
9、福可苏(伊基奥仑赛)
福可苏(伊基奥仑赛),于2023年6月获得NMPA的批准上市,用于治疗复发难治多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂),为国内上市的首个BCMA靶点CAR-T产品。
此次批准是基于一项Ⅰ/ II期临床试验研究,伊基奥仑赛注射液治疗经过至少三线治疗的多发性骨髓瘤患者。有效性方面,103例患者总体缓解率为96.1%,完全缓解率/严格意义的完全缓解率为77.7%。安全性方面,仅出现1例≥3级的细胞因子释放综合征(CRS),无≥3级神经毒性。
声明:本文系转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间处理。
|