|
2020年7月1日,新版《药品生产监督管理办法》正式实施,同时发布了如何申请药品生产许可证(B证,委托他人生产情形),从2020年6月19日,杭州和泽医药科技有限公司获得全国第一张药品研制机构药品生产许可证,至2020年12月21日,在国家药品监督管理总局药品查询数据库,我们通过在“药品生产企业”库中,在分类码输入“B”查询,得到89家获得药品生产许可证(B证)的生产企业,经过梳理,其中贵州2家企业未注明受托企业,故暂时排除在外,我们对余下的87家企业进行了分类解析:
一、按照地域分类:
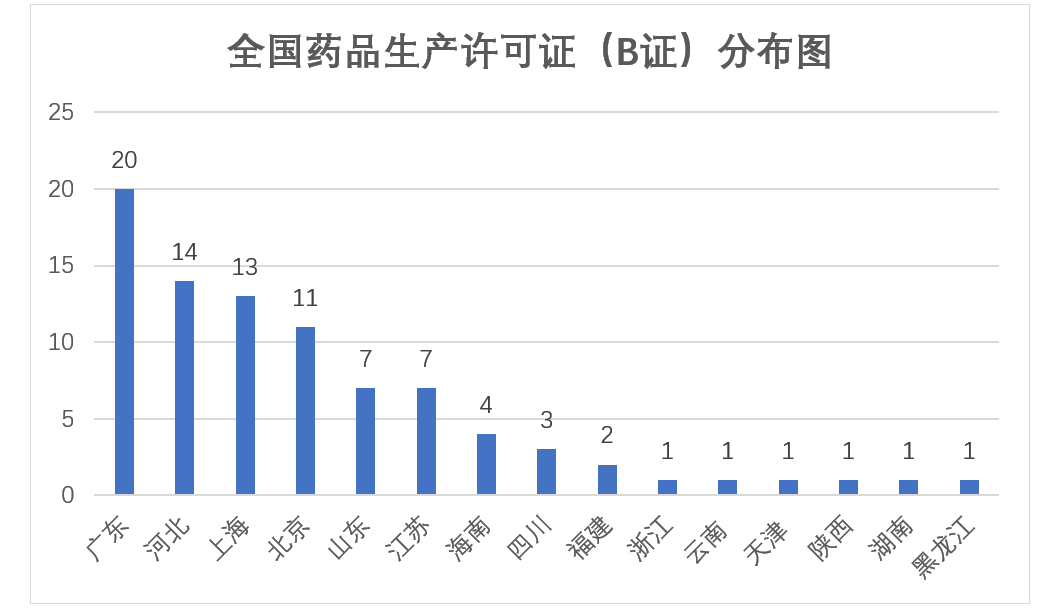
其中原先10个试点省份,拥有79张B证,广东最多拥有20张,河北、上海、北海分别以14、13、11位列第二、第三、第四位,非试点省份中,海南拥有4张,其余云南、陕西、湖南、黑龙江各有1张。
二、按照分类码分类:
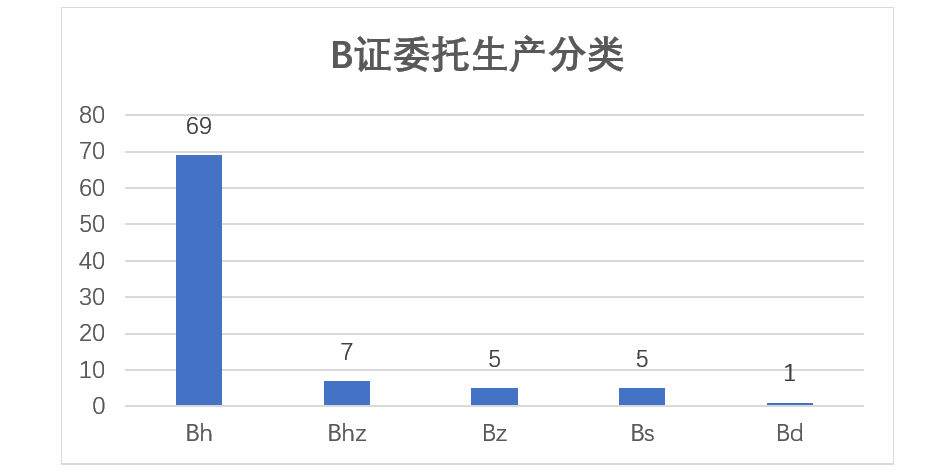
其中以单独化药为生产范围的B证有69张,单独中药B证5张,单独生物制品B证5张,中化药B证7张,以药品管理的诊断试剂B证1张。
三、按照申请原因分类:
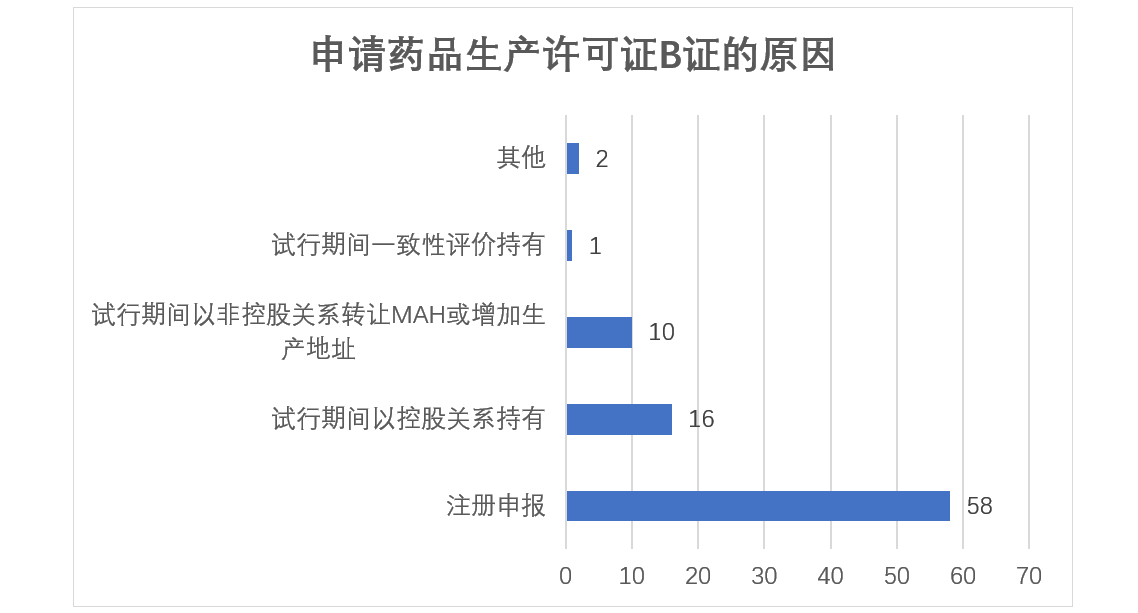
在药品上市许可持有人试行期间,以下情形可以成为药品上市许可持有人:(1) 本方案实施后批准上市的新药;(2) 按与原研药品质量和疗效一致的新标准批准上市的仿制药;(3)通过质量和疗效一致性评价的药品;(4)试点行政区域内,药品生产企业整体搬迁或者被兼并后整体搬迁的,该企业持有药品批准文号的药品。以及(5)药品生产企业集团公司可以将各控股子公司的药品批准文号集中到集团公司持有,成为持有人。(6)执行多点委托生产。
以上企业中除第(5)项里有部分集团公司是原先就拥有药品生产许可证以外,其余企业基本上没有药品生产许可证。国家药监局关于实施新修订《药品生产监督管理办法》有关事项的公告(2020年 第47号)持有人试点期间至新修订《药品注册管理办法》实施前,以委托生产形式获得批准上市的,其持有人应在2020年7月1日前向所在地省级药品监管部门申请办理《药品生产许可证》。
其中,我们把(1)(2)总结为注册申报原因,则有58家企业因新药或仿制药注册申报申请《药品生产许可证》,16家企业因药品生产企业集团公司名义持有文号申请B证,10家企业或以多点委托生产名义或受让药品上市许可持有申请B证。
另外,深圳某制药股份有限公司以药品经营企业以完成化药新4类申报批准获得B证(委托生产)、海南某医药公司以药品经营企业拟并购某制药企业药品文号为由,获得了药品生产许可B证,这也是未来药品上市许可转让放开后,非制药企业受让方需首先获得药品生产许可B证,而在海南省,这类型的企业获得了具体的政策支持,为更多的以药品经营企业为主的非制药企业受让药品上市许可打通了屏障,当然其申报资料、质量体系建设、适用性检查、现场检查都需要严格准备。
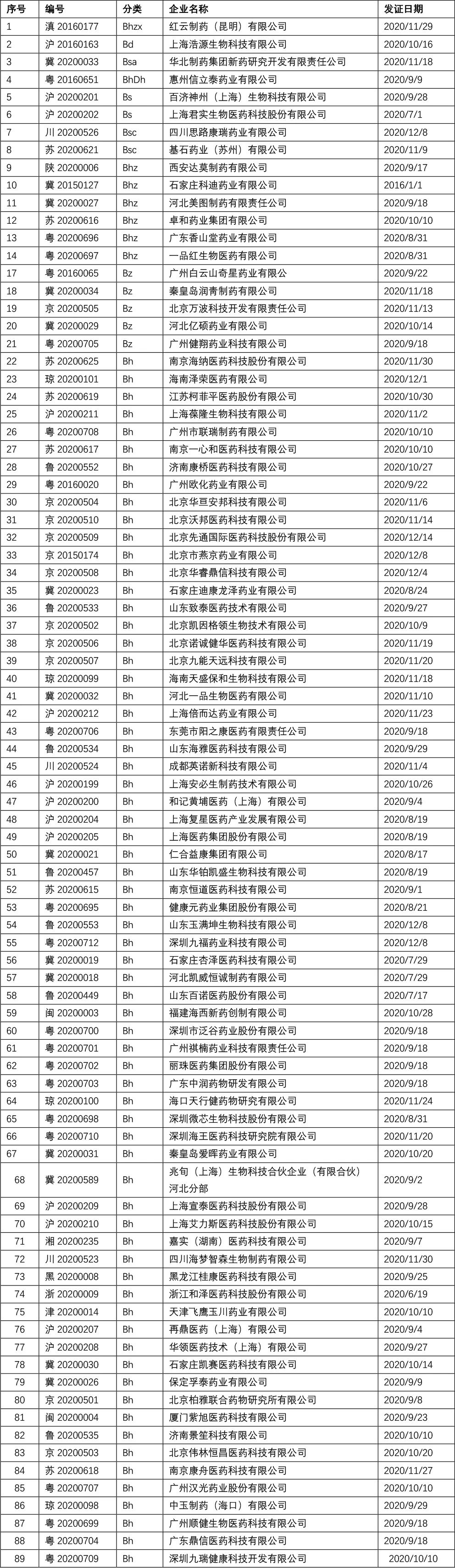
四、全国B证目录:
|